Como Funcionam as Baterias
As baterias são componentes essenciais em nosso dia a dia, alimentando desde pequenos dispositivos eletrônicos até grandes sistemas de armazenamento de energia. Entender como funcionam é fundamental para apreciar a tecnologia por trás desses dispositivos indispensáveis.
Princípio Básico das Baterias
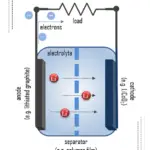
No coração de cada bateria está a célula eletroquímica, que opera com base em reações redox espontâneas. Estas ocorrem em dois eletrodos: o cátodo e o ânodo, separados por um eletrólito. Este último é uma substância que conduz íons, mas é eletricamente isolante. A energia química é armazenada em metais de alta energia, como Zn (zinco) ou Li (lítio), que diferentemente dos metais de transição, não são estabilizados por ligação de elétrons d.
Funcionamento da Bateria
Ao fechar o circuito de uma bateria, o cátodo atrai os elétrons do ânodo através de um fio no circuito. Este fluxo de elétrons através do fio é o que chamamos de eletricidade. Em termos simples, as baterias são projetadas para manter o cátodo e o ânodo separados, prevenindo uma reação direta entre eles. Os elétrons armazenados só fluem quando o circuito é fechado, como ao colocar a bateria em um dispositivo e ligá-lo.
Tipo de Baterias
Existem vários tipos de baterias, cada uma com combinações diferentes de materiais, mas todas utilizam o mesmo princípio de reação de oxidação-redução. Os materiais mais comuns são chumbo, níquel e lítio, cada um com diferentes capacidades e adequados para propósitos específicos.
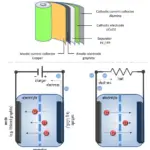
Bateria de Íon de Lítio
Na bateria de íon de lítio, o cátodo é feito de um composto intercalado de lítio e o ânodo geralmente é de grafite poroso. O eletrólito pode ser líquido, polímero ou sólido. Durante a descarga, os íons de lítio migram do ânodo para o cátodo e vice-versa durante o carregamento. Este tipo de bateria é conhecido por sua alta capacidade específica e baixo potencial de eletrodo, tornando-se ideal para baterias de alta voltagem e alta energia.
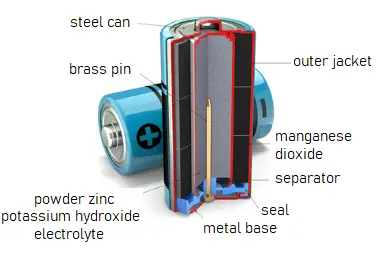
Bateria Alcalina
As baterias alcalinas, por outro lado, usam zinco como ânodo e dióxido de manganês (MnO2) como cátodo. A eletrólise de potássio (KOH) age como eletrólito alcalino. As reações químicas nas baterias alcalinas são:
- Zn(s) + 2OH–(aq) → ZnO(s) + H2O(l) + 2e– [Eoxidação° = +1.28 V]
- 2MnO2(s) + H2O(l) + 2e– → Mn2O3(s) + 2OH–(aq) [Eredução° = +0.15 V]
Reação global: Zn(s) + 2MnO2(s) ⇌ ZnO(s) + Mn2O3(s) [e° = +1.43 V]
Essas baterias fornecem energia elétrica diretamente a partir da reação eletroquímica entre zinco e dióxido de manganês na presença de um eletrólito alcalino.
Aplicações Práticas
Na vida real, as baterias são usadas para alimentar uma variedade de dispositivos, desde telefones celulares e laptops até veículos elétricos e sistemas de armazenamento de energia em grande escala. Compreender seu funcionamento nos ajuda a otimizar seu uso e desenvolver tecnologias mais eficientes e sustentáveis.
Fonte: wikipedia.org