¿Cómo Funcionan las Baterías?
Las baterías son dispositivos esenciales en nuestra vida diaria, alimentando desde teléfonos móviles hasta vehículos eléctricos. Comprender cómo funcionan estas fuentes de energía es fundamental para apreciar la tecnología que impulsa nuestro mundo moderno.
Principio Básico de una Batería
El principio fundamental de una batería, o celda electroquímica, se basa en reacciones de óxido-reducción (redox) espontáneas en dos electrodos separados por un electrolito. Este último es una sustancia que conduce iones y es eléctricamente aislante. La energía química se almacena en metales de alta energía como el Zn o Li, que no están estabilizados por enlaces de electrones d, a diferencia de los metales de transición.
Funcionamiento de las Baterías
Cuando se cierra el circuito, el cátodo (por ejemplo, dióxido de manganeso en baterías alcalinas) atrae los electrones del ánodo (por ejemplo, zinc) a través del alambre en el circuito hacia el electrodo del cátodo. Este flujo de electrones a través del cable es lo que conocemos como electricidad. Las baterías están diseñadas para mantener separados el cátodo y el ánodo y evitar una reacción directa. Los electrones almacenados solo fluyen cuando el circuito se cierra, como cuando se coloca la batería en un dispositivo y este se enciende.
Tipos de Baterías y sus Materiales
Existen diversos tipos de baterías con diferentes combinaciones de materiales, pero todas utilizan el mismo principio de la reacción de oxidación-reducción. Los materiales comunes incluyen plomo, níquel y litio, cada uno con salidas específicas y adecuados para diferentes propósitos según los requisitos.
Baterías de Ión-Litio
Las baterías de iones de litio son un tipo de batería recargable. En ellas, los iones de litio se mueven del ánodo al cátodo durante la descarga y viceversa durante la carga. El cátodo se compone de un material compuesto (un compuesto intercalado de litio) y el ánodo suele ser de grafito poroso. El electrolito puede ser líquido, polímero o sólido.
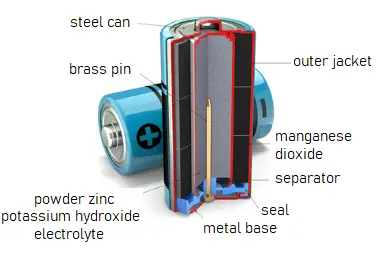
Funcionamiento de las Baterías Alcalinas
Las baterías alcalinas son un tipo de batería primaria que utiliza una reacción electroquímica entre el zinc y el dióxido de manganeso (MnO2) en presencia de un electrolito alcalino. El electrolito de hidróxido de potasio, KOH, no se consume durante la reacción. Las reacciones en estas baterías son:
- Zn(s) + 2OH–(aq) → ZnO(s) + H2O(l) + 2e– [Eoxidación° = +1.28 V]
- 2MnO2(s) + H2O(l) + 2e– → Mn2O3(s) + 2OH–(aq) [Ereducción° = +0.15 V]
La reacción global es: Zn(s) + 2MnO2(s) ⇌ ZnO(s) + Mn2O3(s) [e° = +1.43 V]
Aplicación de las Baterías en el Mundo Real
En resumen, las baterías convierten la energía química almacenada en energía eléctrica a través de un proceso electroquímico, proporcionando una fuente de fuerza electromotriz que permite el flujo de corrientes en circuitos eléctricos y electrónicos. Esta transformación de energía es fundamental para el funcionamiento de innumerables dispositivos en nuestra vida cotidiana.