Wie Batterien Funktionieren
In der modernen Welt sind Batterien unverzichtbare Energiequellen für zahlreiche Geräte. Aber wie funktionieren sie eigentlich? Dieser Artikel bietet einen Einblick in die Grundlagen der Batterietechnologie und deren Arbeitsweise.
Grundprinzip der elektrochemischen Zelle
Das Herzstück jeder Batterie ist die elektrochemische Zelle. Sie basiert auf spontanen Redoxreaktionen zwischen zwei Elektroden, die durch einen Elektrolyten getrennt sind. Der Elektrolyt ist eine Substanz, die ionisch leitfähig, aber elektrisch isolierend ist. Chemische Energie wird in Metallen wie Zn oder Li gespeichert, die aufgrund fehlender d-Elektronenbindung eine hohe Energie aufweisen, im Gegensatz zu Übergangsmetallen.
Wie der Stromfluss entsteht
Wenn der Stromkreis geschlossen wird, zieht die stärkere Anziehungskraft des Kathodenmaterials (z.B. Mangandioxid in Alkalibatterien) die Elektronen von der Anode (z.B. Zink) durch den Draht im Schaltkreis zur Kathodenelektrode. Diese Bewegung der Elektronen erzeugt elektrischen Strom. Im Wesentlichen verhindert jede Batterie die direkte Reaktion von Kathode und Anode, um einen kontrollierten Elektronenfluss zu ermöglichen, der nur eintritt, wenn der Stromkreis geschlossen ist.
Umwandlung von chemischer in elektrische Energie
Batterien wandeln gespeicherte chemische Energie durch einen elektrochemischen Prozess in elektrische Energie um. Typischerweise bestehen Batterien aus einer oder mehreren voltaischen Zellen, die alle auf dem Prinzip der Oxidations-Reduktions-Reaktion basieren.
Vielfalt der Batterietypen
Obwohl es eine Vielzahl von Batterietypen gibt, die verschiedene Materialkombinationen nutzen, folgen alle demselben Oxidations-Reduktions-Prinzip. Die gebräuchlichsten Materialien sind Blei, Nickel und Lithium, die jeweils unterschiedliche Leistungsmerkmale aufweisen und für verschiedene Zwecke geeignet sind.
Prinzip der Lithium-Ionen-Batterie
Lithium-Ionen-Batterien sind Sekundärbatterien, in denen Lithium-Ionen während der Entladung von der Anode durch einen Elektrolyten zur Kathode wandern und beim Laden zurückkehren. Sie bestehen aus einer Kathode aus einem Lithium-Verbundmaterial, einer Anode aus porösem Graphit und einem Elektrolyten, der flüssig, polymer oder fest sein kann. Lithium ist ideal für Hochspannungs- und Hochenergiebatterien.
Während der Entladung wird Lithium an der Lithium-Graphit-Anode oxidiert (C6Li → 6C + Li+ + e−), und die Lithium-Ionen wandern durch den Elektrolyten zur Kathode, wo sie in Lithium-Kobaltoxid eingebaut werden (CoO2 + Li+ + e− → LiCoO2). Diese Reaktionen sind umkehrbar, wodurch die Zelle wieder aufgeladen werden kann.
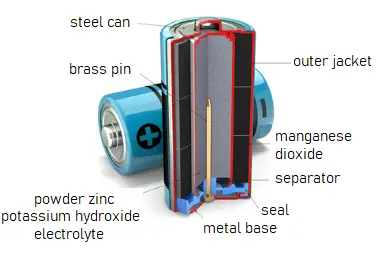
Funktionsweise der Alkalibatterie
Alkalibatterien sind Primärbatterien, bei denen elektrischer Strom aus der Reaktion zwischen Zink und Mangandioxid (MnO2) in einer alkalischen Elektrolytlösung von Kaliumhydroxid (KOH) erzeugt wird. Die Halbreaktionen sind:
- Zink: Zn(s) + 2OH−(aq) → ZnO(s) + H2O(l) + 2e− [Eoxidation° = +1.28 V]
- Mangandioxid: 2MnO2(s) + H2O(l) + 2e− → Mn2O3(s) + 2OH−(aq) [Ereduction° = +0.15 V]
Gesamte Reaktion: Zn(s) + 2MnO2(s) ⇌ ZnO(s) + Mn2O3(s) [e° = +1.43 V]
Die durch die Reaktion erzeugten Elektronen werden verwendet, um Geräte mit Strom zu versorgen, wenn der Schaltkreis geschlossen ist. So funktionieren Batterien in der Praxis.