Comment fonctionnent les batteries
Le principe fondamental d’une cellule électrochimique repose sur les réactions redox spontanées dans deux électrodes, séparées par un électrolyte. Cet électrolyte est une substance conductrice ionique et électriquement isolante. L’énergie chimique peut être stockée, par exemple, dans le Zn ou le Li, des métaux à haute énergie, car ils ne sont pas stabilisés par des liaisons d’électrons d, contrairement aux métaux de transition.
Le processus chimique dans une batterie
Lorsque le circuit est fermé, l’attraction plus forte pour les électrons par la cathode (par exemple le dioxyde de manganèse dans les batteries alcalines) attire les électrons de l’anode (par exemple le zinc) à travers le fil dans le circuit vers l’électrode cathodique. Cette réaction chimique de la batterie, ce flux d’électrons à travers le fil, est l’électricité.
Principe de fonctionnement d’une batterie
En termes simples, chaque batterie est conçue pour garder la cathode et l’anode séparées afin d’éviter une réaction. Les électrons stockés ne circuleront que lorsque le circuit sera fermé. Cela se produit lorsque la batterie est placée dans un appareil et que l’appareil est allumé. Une batterie électrique est essentiellement une source d’énergie électrique continue (DC).
Les batteries convertissent l’énergie chimique stockée en énergie électrique grâce à un processus électrochimique. Elles fournissent ainsi une source de force électromotrice pour permettre aux courants de circuler dans les circuits électriques et électroniques. Une batterie typique est composée d’une ou plusieurs cellules voltaïques.
Types et matériaux des batteries
Bien qu’il existe une large gamme de types de batteries avec différentes combinaisons de matériaux, toutes utilisent le même principe de réaction d’oxydoréduction. Les batteries sont conçues de manière à ce que la réaction redox énergétiquement favorable ne puisse se produire que lorsque les électrons se déplacent à travers la partie externe du circuit. Les batteries sont fabriquées à partir d’une vaste gamme de matériaux, résultant en différentes capacités et comportements dans la fonctionnalité de la batterie. Les plus courantes sont le plomb, le nickel et le lithium, chacune ayant des sorties différentes et spécifiques à certains usages en fonction des besoins.
Fonctionnement de la batterie lithium-ion
Une batterie lithium-ion, également connue sous le nom de batterie Li-ion, est un type de batterie secondaire (rechargeable) composée de cellules dans lesquelles les ions lithium se déplacent de l’anode à travers un électrolyte vers la cathode pendant la décharge et inversement lors de la charge. La cathode est faite d’un matériau composite (un composé de lithium intercalé) et définit le nom de la cellule de batterie Li-ion. L’anode est généralement faite de graphite poreux. L’électrolyte peut être liquide, polymère ou solide.
Le lithium métallique est le métal le plus léger et possède une capacité spécifique élevée (3,86 Ah/g) et un potentiel d’électrode extrêmement bas (-3,04 V par rapport à l’électrode standard à hydrogène). Par conséquent, le lithium est un matériau d’anode idéal pour les batteries à haute tension et à haute énergie. Pendant la décharge, le lithium est oxydé de Li à Li+ (état d’oxydation de 0 à +1) dans l’anode en graphite de lithium selon la réaction suivante : C6Li → 6C(graphite) + Li+ + e–. Ces ions lithium migrent à travers le milieu électrolytique vers la cathode, où ils sont incorporés dans le dioxyde de cobalt de lithium selon la réaction suivante, qui réduit le cobalt d’un état d’oxydation de +4 à +3 : CoO2(s) + Li+ + e– → LiCoO2(s). Voici la réaction complète (de gauche à droite = décharge, de droite à gauche = charge) : C6Li + CoO2 ⇄ C6 + LiCoO2.
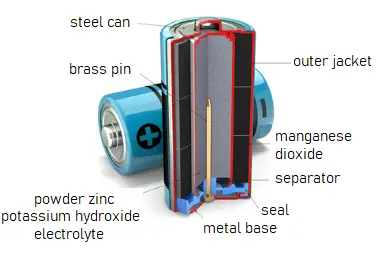
Fonctionnement de la batterie alcaline
Une batterie alcaline (code IEC : L) est un type de batterie primaire qui fournit un courant électrique direct à partir de la réaction électrochimique entre le zinc et le dioxyde de manganèse (MnO2) en présence d’un électrolyte alcalin. Dans une batterie alcaline, l’électrode négative est le zinc, et l’électrode positive est le dioxyde de manganèse à haute densité (MnO2). L’électrolyte alcalin de l’hydroxyde de potassium, KOH, n’est pas consommé pendant la réaction. Seuls le zinc et MnO2 sont consommés pendant la décharge. L’électrolyte alcalin de l’hydroxyde de potassium reste, car il y a des quantités égales d’OH– consommées et produites.
Les demi-réactions sont : Zn(s) + 2OH–(aq) → ZnO(s) + H2O(l) + 2e– [Eoxydation° = +1.28 V] 2MnO2(s) + H2O(l) + 2e– → Mn2O3(s) + 2OH–(aq) [Eréduction° = +0.15 V] Réaction globale : Zn(s) + 2MnO2(s) ⇌ ZnO(s) + Mn2O3(s) [e° = +1.43 V]
En appliquant cette chimie de batterie au monde réel, les électrons générés pendant la réaction sont utilisés pour alimenter les appareils lorsque le circuit est fermé. C’est simplement ainsi que fonctionnent les batteries.