O Funcionamento da Bateria de Íon de Lítio
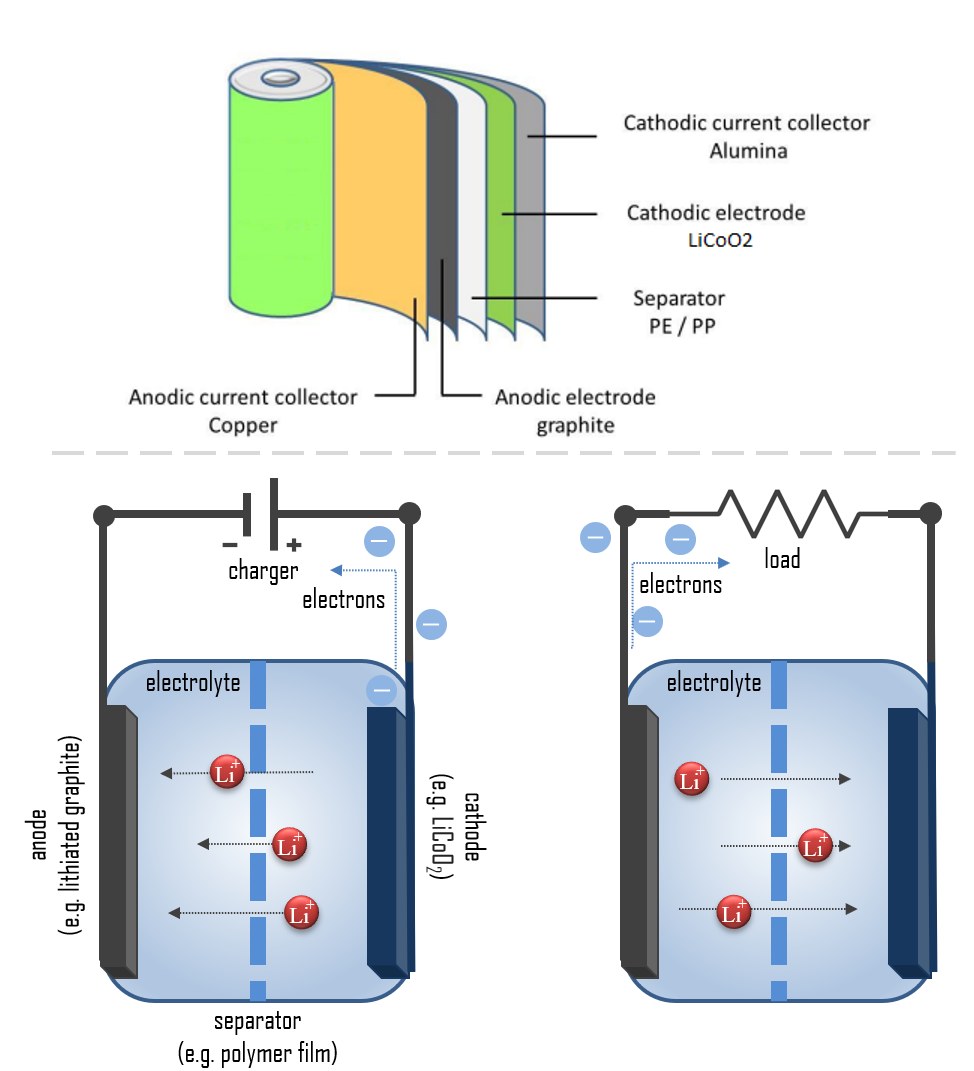
As baterias de íon de lítio, conhecidas como baterias Li-ion, são um tipo de bateria secundária (recarregável) composta por células onde os íons de lítio se movem do ânodo para o cátodo através de um eletrólito durante a descarga e retornam quando carregadas. O cátodo é feito de um material compósito (um composto intercalado de lítio) e define o nome da célula da bateria Li-ion. O ânodo é geralmente feito de grafite litianado poroso. O eletrólito pode ser líquido, polímero ou sólido. O separador é poroso para permitir o transporte de íons de lítio e evitar curto-circuito e fuga térmica na célula.
Características e Usos
As características de química, desempenho, custo e segurança variam entre os tipos de baterias de íon de lítio. Eletrônicos portáteis geralmente utilizam baterias de polímero de lítio (com um gel polímero como eletrólito), um material de cátodo de óxido de cobalto de lítio (LiCoO2) e um ânodo de grafite, que oferecem alta densidade de energia. As baterias Li-ion, em geral, têm alta densidade de energia, nenhum efeito memória e baixa autodescarga. Um dos tipos mais comuns de células é a bateria 18650, utilizada em muitas baterias de computadores portáteis, ferramentas elétricas sem fio, certos carros elétricos, patinetes elétricos, a maioria das bicicletas elétricas, bancos de energia portáteis e lanternas LED. A tensão nominal é de 3,7 V.
Química da Bateria de Íon de Lítio
Uma bateria elétrica é essencialmente uma fonte de energia elétrica de corrente contínua. Ela converte energia química armazenada em energia elétrica através de um processo eletroquímico. O princípio fundamental em uma célula eletroquímica é as reações redox espontâneas em dois eletrodos separados por um eletrólito, que é uma substância condutora iônica e eletricamente isolante.
Funcionamento Detalhado
Em termos simples, cada bateria é projetada para manter o cátodo e o ânodo separados para evitar uma reação. Os elétrons armazenados só fluem quando o circuito está fechado. Isso ocorre quando a bateria é colocada em um dispositivo e o dispositivo é ligado. Quando o circuito é fechado, a atração mais forte pelos elétrons pelo cátodo (por exemplo, LiCoO2 em baterias de íon de lítio) puxa os elétrons do ânodo (por exemplo, grafite de lítio) através do fio no circuito para o eletrodo de cátodo. Esta reação química da bateria, este fluxo de elétrons através do fio, é a eletricidade.
Durante a descarga, o lítio é oxidado de Li para Li+ (estado de oxidação de 0 para +1) no ânodo de grafite de lítio através da seguinte reação: C6Li → 6C(grafite) + Li+ + e-. Estes íons de lítio migram através do meio eletrólito para o cátodo, onde são incorporados ao óxido de cobalto de lítio através da seguinte reação, que reduz o cobalto de um estado de oxidação +4 para +3: CoO2(s) + Li+ + e- → LiCoO2(s).
Essas reações podem ser revertidas para recarregar a célula. Neste caso, os íons de lítio deixam o cátodo de óxido de cobalto de lítio e migram de volta para o ânodo, onde são reduzidos de volta a lítio neutro e reincorporados na rede de grafite.
Conclusão
Embora existam muitos tipos de baterias com diferentes combinações de materiais, todas elas usam o mesmo princípio da reação de oxidação-redução. Em uma célula eletroquímica, reações redox espontâneas ocorrem em dois eletrodos separados por um eletrólito, que é uma substância condutora iônica e eletricamente isolante. A reação redox é uma reação química que produz uma mudança nos estados de oxidação dos átomos envolvidos. Os elétrons são transferidos de um elemento para outro. Como resultado, o elemento doador, que é o ânodo, é oxidado (perde elétrons), e o elemento receptor, o cátodo, é reduzido (ganha elétrons).