La Batería de Ion de Litio: Funcionamiento y Características
La batería de ion de litio, conocida comúnmente como batería Li-ion, es un tipo de batería secundaria (recargable) que se compone de células donde los iones de litio se mueven desde el ánodo a través de un electrolito hacia el cátodo durante la descarga y viceversa durante la carga. Estas baterías son fundamentales en numerosos dispositivos electrónicos debido a su alta densidad de energía, ausencia de efecto memoria y baja autodescarga.
Composición y Tipos
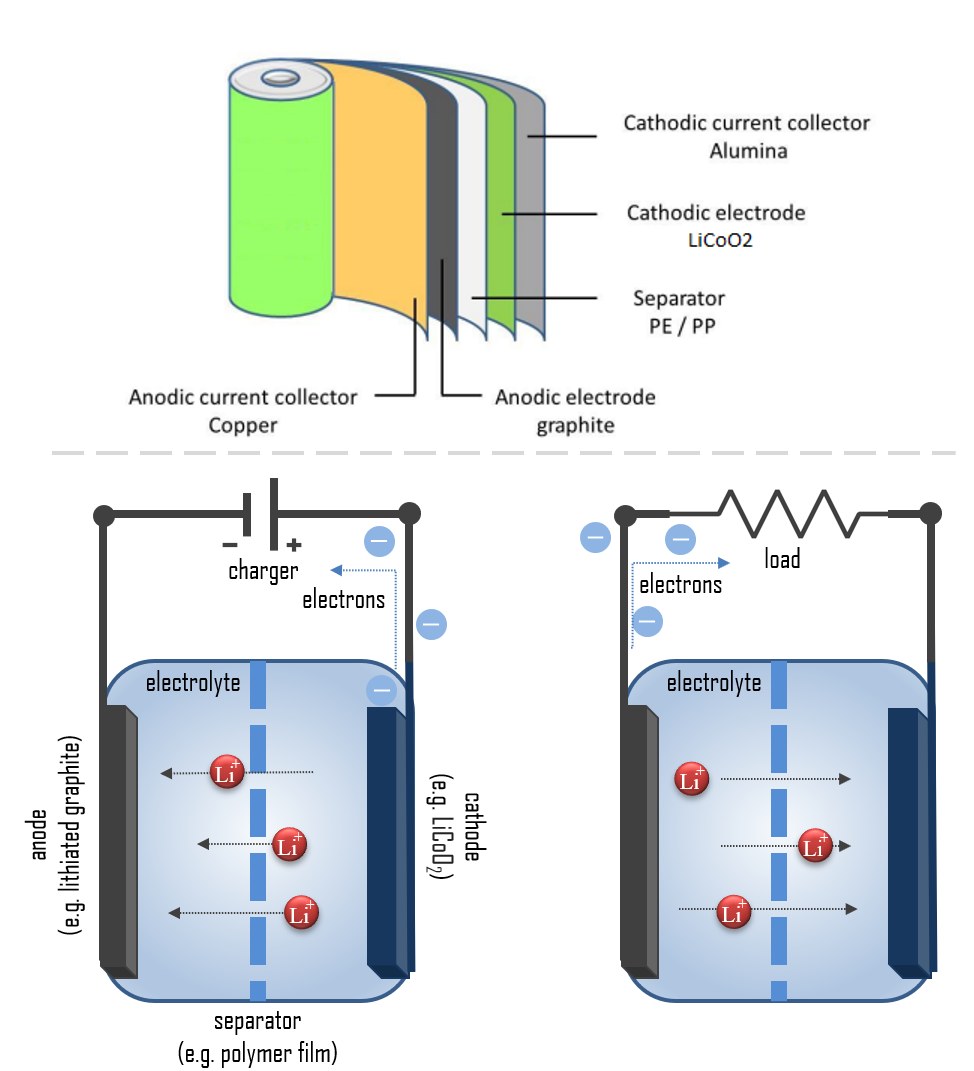
El cátodo de la batería Li-ion está hecho de un compuesto compuesto (un compuesto de litio intercalado), mientras que el ánodo suele ser de grafito lituado poroso. El electrolito puede ser líquido, polímero o sólido, y el separador es poroso para permitir el transporte de iones de litio y prevenir cortocircuitos y sobrecalentamiento. La química, el rendimiento, el costo y las características de seguridad varían según el tipo de batería de ion de litio.
Uso en Electrónica Portátil
Los dispositivos electrónicos portátiles suelen utilizar baterías de polímero de litio con un gel polimérico como electrolito, un material de cátodo de óxido de cobalto de litio (LiCoO2) y un ánodo de grafito. Estas baterías ofrecen una alta densidad de energía. Un tipo común de célula es la batería 18650, utilizada en muchas computadoras portátiles, herramientas eléctricas inalámbricas, algunos coches eléctricos, scooters eléctricos, la mayoría de las bicicletas eléctricas, bancos de energía portátiles y linternas LED. La tensión nominal es de 3.7 V.
Funcionamiento Químico
Un batería eléctrica es esencialmente una fuente de energía eléctrica de CC. Convierte la energía química almacenada en energía eléctrica a través de un proceso electroquímico. En términos simples, cada batería está diseñada para mantener el cátodo y el ánodo separados para prevenir una reacción. Los electrones almacenados solo fluirán cuando el circuito esté cerrado. Esto ocurre cuando la batería se coloca en un dispositivo y el dispositivo se enciende.
Durante la descarga, el litio se oxida de Li a Li+ (estado de oxidación de 0 a +1) en el ánodo de grafito-litio a través de la reacción: C6Li → 6C (grafito) + Li+ + e-. Estos iones de litio migran a través del medio electrolítico hacia el cátodo, donde se incorporan en el óxido de cobalto de litio a través de la reacción que reduce el cobalto de un estado de oxidación de +4 a +3: CoO2 (s) + Li+ + e- → LiCoO2 (s). La reacción completa es: C6Li + CoO2 ⇄ C6 + LiCoO2.
El Proceso de Carga
Durante el proceso de carga, los iones de Li+ se mueven del ánodo de Li y pasan a través del separador empapado en electrolito, finalmente intercalándose en la estructura del cátodo. Como resultado, los electrones pasan a través del circuito externo en la dirección opuesta. Durante la descarga, los electrones fluyen a través del circuito externo desde el electrodo negativo (ánodo) hacia el electrodo positivo (cátodo). Las reacciones durante la descarga bajan el potencial químico de la célula, por lo que la descarga transfiere energía de la célula al lugar donde la corriente eléctrica disipa su energía, principalmente en el circuito externo.
Principios Electroquímicos
Todas las baterías funcionan con el mismo principio de la reacción de oxidación-reducción. En una celda electroquímica, las reacciones redox espontáneas ocurren en dos electrodos separados por un electrolito, que es una sustancia conductora iónica y eléctricamente aislante. La reacción redox es una reacción química que produce un cambio en los estados de oxidación de los átomos involucrados. Se transfieren electrones de un elemento a otro, resultando en la oxidación del elemento donante, el ánodo, y la reducción del elemento receptor, el cátodo.
Conclusión
Las baterías de ion de litio son esenciales en nuestra vida cotidiana, impulsando una amplia gama de dispositivos desde teléfonos móviles hasta vehículos eléctricos. Comprender su funcionamiento y composición es clave para apreciar su importancia y las innovaciones continuas en el campo de la tecnología de baterías.