La Batterie Lithium-Ion : Fonctionnement et Principes
Introduction
La batterie lithium-ion, connue sous le nom de batterie Li-ion, est un type de batterie rechargeable. Dans ces cellules, les ions lithium se déplacent de l’anode à la cathode pendant la décharge et inversement lors de la charge. Cet article explore la chimie, les performances, les coûts et les caractéristiques de sécurité des batteries lithium-ion.
Composition et Types
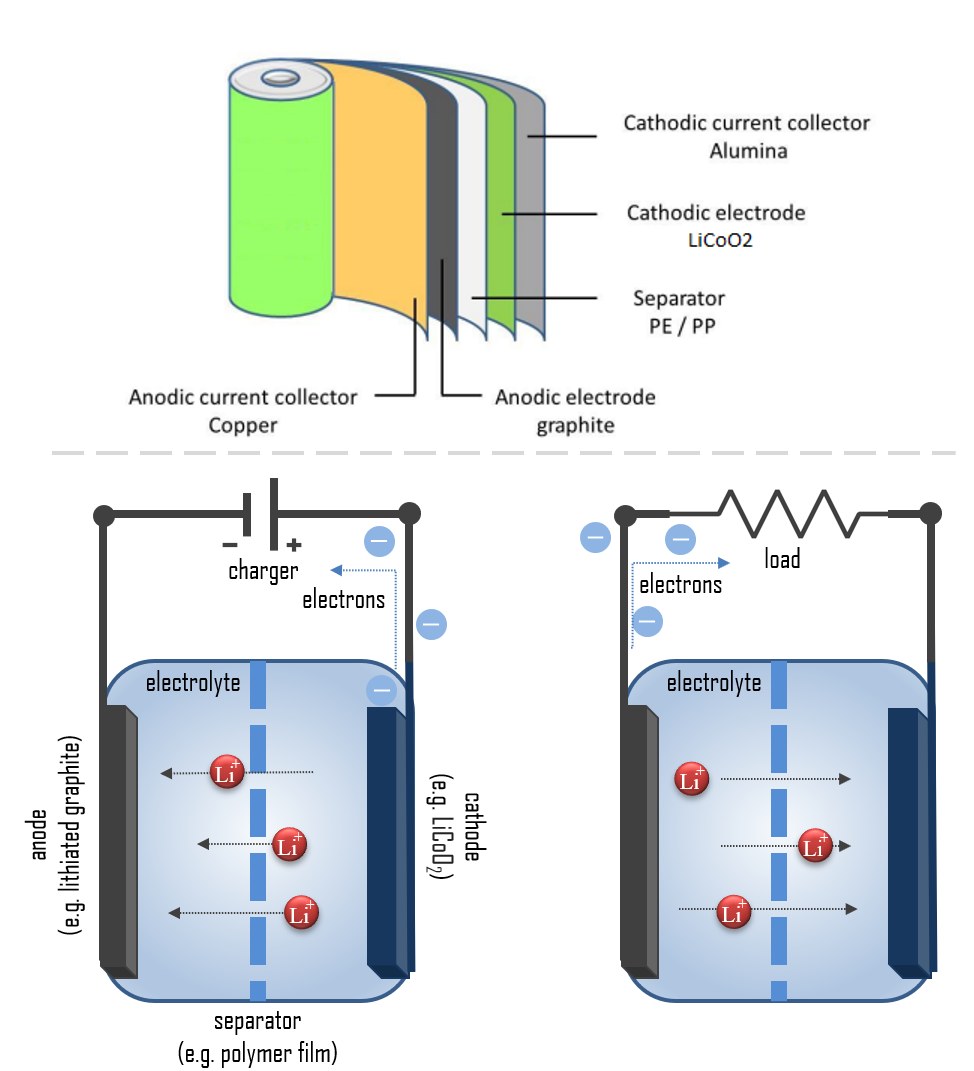
La cathode d’une batterie Li-ion est composée d’un matériau composite (un composé lithium intercalé) qui détermine son nom. L’anode est généralement faite de graphite lithié poreux. L’électrolyte peut être liquide, polymère ou solide, et le séparateur est poreux pour permettre le transport des ions lithium tout en prévenant les courts-circuits et la surchauffe.
Utilisations et Caractéristiques
Les batteries lithium-ion sont largement utilisées dans les appareils électroniques portables, les outils électriques sans fil, certains véhicules électriques, les trottinettes électriques, la plupart des vélos électriques, les banques d’alimentation portables et les lampes de poche LED. Elles se caractérisent par une haute densité énergétique, l’absence d’effet mémoire et une faible auto-décharge. Un exemple courant est la batterie 18650, souvent utilisée dans les ordinateurs portables et d’autres appareils.
Chimie d’une Batterie Lithium-Ion
Une batterie électrique transforme l’énergie chimique stockée en énergie électrique via un processus électrochimique, fournissant ainsi une force électromotrice pour les circuits électriques. La batterie lithium-ion fonctionne sur le principe des réactions redox spontanées dans deux électrodes séparées par un électrolyte.
Le Processus de Décharge et de Charge
Pendant la décharge, le lithium est oxydé de Li à Li+ dans l’anode en graphite, selon la réaction : C6Li → 6C(graphite) + Li+ + e–. Ces ions lithium migrent à travers l’électrolyte vers la cathode, où ils s’incorporent dans l’oxyde de cobalt de lithium, réduisant le cobalt d’un état d’oxydation +4 à +3 : CoO2 (s) + Li+ + e– → LiCoO2 (s). Cette réaction peut être inversée pour recharger la cellule.
Le Principe des Réactions Redox
Dans une cellule électrochimique, des réactions redox spontanées ont lieu dans deux électrodes séparées par un électrolyte. La réaction redox est une réaction chimique qui produit un changement dans les états d’oxydation des atomes impliqués. Les électrons sont transférés d’un élément à un autre, oxydant l’anode (perte d’électrons) et réduisant la cathode (gain d’électrons).
Conclusion
Les batteries lithium-ion, avec leurs diverses applications et caractéristiques uniques, sont des composants essentiels de nombreux appareils modernes. Leur capacité à stocker et convertir l’énergie chimique en énergie électrique de manière efficace les rend indispensables dans notre monde technologique.