리튬 이온 배터리의 원리와 작동 방식
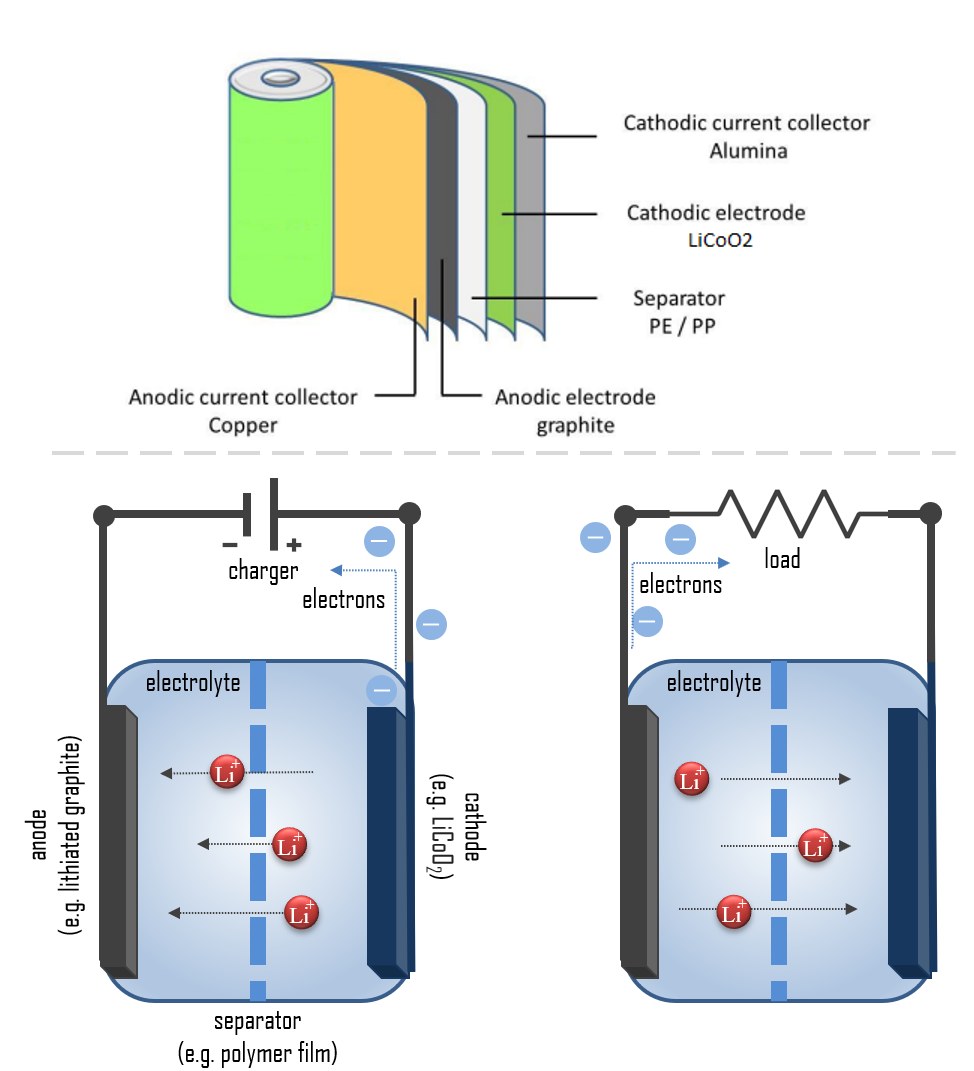
리튬 이온 배터리, 즉 Li-ion 배터리는 이차(충전 가능한) 배터리의 한 종류로, 배터리 셀 내에서 리튬 이온이 양극에서 음극으로 이동하며 방전되고, 충전 시 다시 음극에서 양극으로 이동한다. 이 배터리는 고체, 액체, 또는 폴리머 전해질을 사용하며, 양극은 리튬 화합물로 만들어진다. 음극은 주로 다공성 리튬 처리된 흑연으로 제작된다. 분리막은 리튬 이온의 이동을 가능하게 하면서도 셀의 단락 및 열적 폭주를 방지한다.
리튬 이온 배터리의 다양한 화학 구성
리튬 이온 배터리는 종류에 따라 화학적 구성, 성능, 비용 및 안전 특성이 다양하다. 대부분의 휴대용 전자 제품은 고에너지 밀도를 제공하는 리튬 폴리머 배터리(폴리머 겔 전해질 사용)를 사용하며, 이 배터리는 리튬 코발트 산화물(LiCoO2) 양극 물질과 흑연 음극을 사용한다. 일반적으로 리튬 이온 배터리는 높은 에너지 밀도, 기억 효과 없음, 낮은 자가 방전을 특징으로 한다.
리튬 이온 배터리의 일반적인 사용
가장 일반적인 셀 유형 중 하나는 노트북 컴퓨터 배터리, 무선 전동 공구, 일부 전기 자동차, 전기 킥보드, 대부분의 전기 자전거, 휴대용 파워 뱅크, LED 손전등에 사용되는 18650 배터리다. 이 배터리의 정격 전압은 3.7V이다. 일회용 1차 리튬 배터리(예: 리튬 버튼 셀 CR2032 3V)와 충전 가능한 2차 리튬 이온 또는 리튬 폴리머 배터리를 구별해야 한다.
리튬 이온 배터리의 화학적 원리
전기 배터리는 본질적으로 DC 전기 에너지의 원천이며, 저장된 화학 에너지를 전기 에너지로 변환하는 전기화학 과정을 거친다. 전형적인 배터리는 하나 이상의 전지로 구성된다. 전기화학 전지의 기본 원리는 두 전극 사이의 전해질에 의해 분리된 자발적인 산화 환원 반응이다.
배터리가 작동하는 방식을 간단히 설명하면, 각 배터리는 양극과 음극이 반응하지 않도록 분리되도록 설계되어 있다. 저장된 전자는 회로가 닫힐 때만 흐른다. 이는 배터리가 장치에 설치되고 장치가 켜질 때 발생한다. 회로가 닫히면, 양극(예: 리튬 이온 배터리의 LiCoO2)에 의한 전자에 대한 더 강한 인력이 회로의 와이어를 통해 음극(예: 리튬-흑연)에서 전자를 끌어당긴다. 이 전기화학 반응, 즉 와이어를 통한 전자의 흐름이 전기이다.
리튬 이온 배터리에서는 방전 중에 리튬이 Li에서 Li+로 산화되며, 다음 반응을 거친다: C6Li → 6C(흑연) + Li+ + e-. 이 리튬 이온은 전해질 매체를 통해 이동하여 양극에서 리튬 코발트 산화물로 통합된다. 전체 반응은 다음과 같다: C6Li + CoO2 ⇄ C6 + LiCoO2. 이 반응들은 셀을 재충전하기 위해 역방향으로 실행될 수 있다.
배터리의 충전 및 방전 과정
충전 과정 중, Li+ 이온은 리튬 함유 양극에서 이동하여 전해질로 적신 분리막을 통과한 후, 음극 호스트 구조로 개재된다. 결과적으로, 전자는 외부 회로를 통해 반대 방향으로 이동한다. 방전 중에는 전자가 외부 회로를 통해 음극에서 양극으로 흐른다. 방전 중의 반응은 셀의 화학적 잠재력을 감소시키므로, 방전은 전기가 소비되는 외부 회로로 에너지를 전달한다. 충전 중에는 이러한 반응과 이동이 반대 방향으로 진행된다.