リチウムイオン電池の仕組み
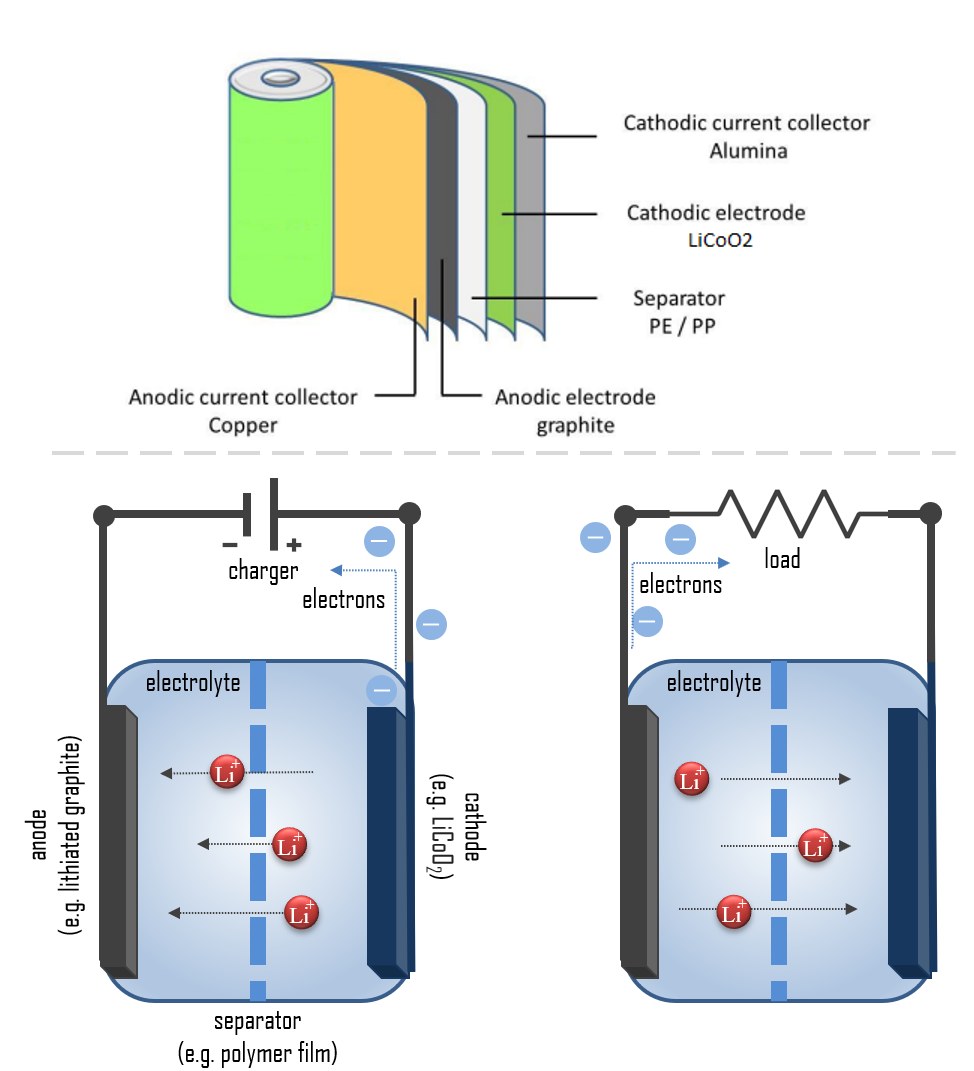
リチウムイオン電池、またはLi-ion電池とも呼ばれるこのタイプの二次(充電可能)電池は、放電時に陰極から電解質を通って陽極に移動するリチウムイオンによって構成されています。充電時にはその逆の動きが起こります。この電池の陰極は、リチウム化合物(インターカレーションリチウム化合物)の複合材料で作られており、Li-ion電池セルの名前の由来となっています。陽極は通常、多孔質のリチウム化されたグラファイトで作られています。電解質には液体、ポリマー、固体があります。セパレータは多孔質であり、リチウムイオンの輸送を可能にし、セルの短絡と熱暴走を防ぎます。リチウムイオン電池の化学的性質、性能、コスト、安全性は、タイプによって異なります。
リチウムイオン電池の使用
携帯電子機器には主にリチウムポリマー電池が使用されており(ポリマージェルを電解質として)、リチウムコバルト酸化物(LiCoO2)を陰極材料とし、グラファイトを陽極として高いエネルギー密度を提供します。リチウムイオン電池は一般的に高いエネルギー密度、記憶効果のなさ、自己放電率の低さを持ちます。最も一般的なセルタイプの一つが18650電池で、多くのノートパソコンのバッテリーやコードレス電動工具、特定の電気自動車、電動キックスクーター、ほとんどの電動自転車、携帯用電源バンク、LED懐中電灯に使用されています。公称電圧は3.7Vです。リチウム一次電池(CR2032 3Vのようなリチウムボタン電池など)は充電可能な二次リチウムイオンまたはリチウムポリマー電池とは区別されるべきです。リチウム一次電池には金属リチウムが含まれていますが、リチウムイオン電池には含まれていません。
リチウムイオン電池の化学
電気バッテリーは、基本的にDC電気エネルギーの源です。それは、化学エネルギーを電気エネルギーに変換する電気化学的過程を通して行います。これにより、電気および電子回路内で電流が流れるための起電力が提供されます。典型的なバッテリーは一つ以上のボルタ電池から成り立っています。
電気化学電池の基本原理は、電解質によって分離された二つの電極における自発的な酸化還元反応です。電解質はイオン伝導性と電気的に絶縁する物質です。しかし、このような電池はどのように機能するのでしょうか?
簡単に言えば、各バッテリーは陰極と陽極を分離して反応を防ぐように設計されています。保存された電子は、電池がデバイスに設置され、デバイスがオンになると回路が閉じるときにのみ流れます。回路が閉じると、陰極(例えばリチウムイオン電池のLiCoO2)による電子への強い引力が、陽極(例えばリチウムグラファイト)から回路内のワイヤーを通って陰極電極に電子を引っ張ります。この電池化学反応、この電子の流れが電気です。
もっと詳しく言うと、バッテリーは化学エネルギーを直接電気エネルギーに変換します。化学エネルギーは、例えばZnやLiのような高エネルギー金属に保存されます。これらの金属は、遷移金属と異なりd電子結合によって安定化されていないため、高エネルギーです。リチウム金属は最軽量の金属であり、高い特定容量(3.86 Ah/g)と極めて低い電極電位(−3.04 V vs. 標準水素電極)を持っているため、高電圧および高エネルギー電池にとって理想的な陽極材料です。
放電中、リチウムはリチウムグラファイト陽極で以下の反応を通じてLiからLi+(0から+1の酸化状態)に酸化されます:
C6Li → 6C(グラファイト) + Li+ + e-
これらのリチウムイオンは電解質媒体を通って移動し、陰極で以下の反応を経てリチウムコバルト酸化物に組み込まれ、そこでコバルトは+4から+3の酸化状態に還元されます:
CoO2(s) + Li+ + e- → LiCoO2(s)
ここに完全な反応があります(左から右 = 放電、右から左 = 充電):
C6Li + CoO2 ⇄ C6 + LiCoO2
これらの反応は、セルの充電時に逆に実行することができます。この場合、リチウムイオンはリチウムコバルト酸化物陰極から離れ、電解質を浸したセパレーターを通過して最終的に陽極ホスト構造にインターカレーションされ、中性リチウムに還元されてグラファイトネットワークに再組み込まれます。