Riepilogo di 30 secondi
Cariche elettriche negli atomi
Le cariche elettriche negli atomi sono trasportate da protoni ed elettroni.
Gli atomi sono definiti come i più piccoli costituenti della materia ordinaria, che possono essere divisi senza il rilascio di particelle caricate elettricamente.
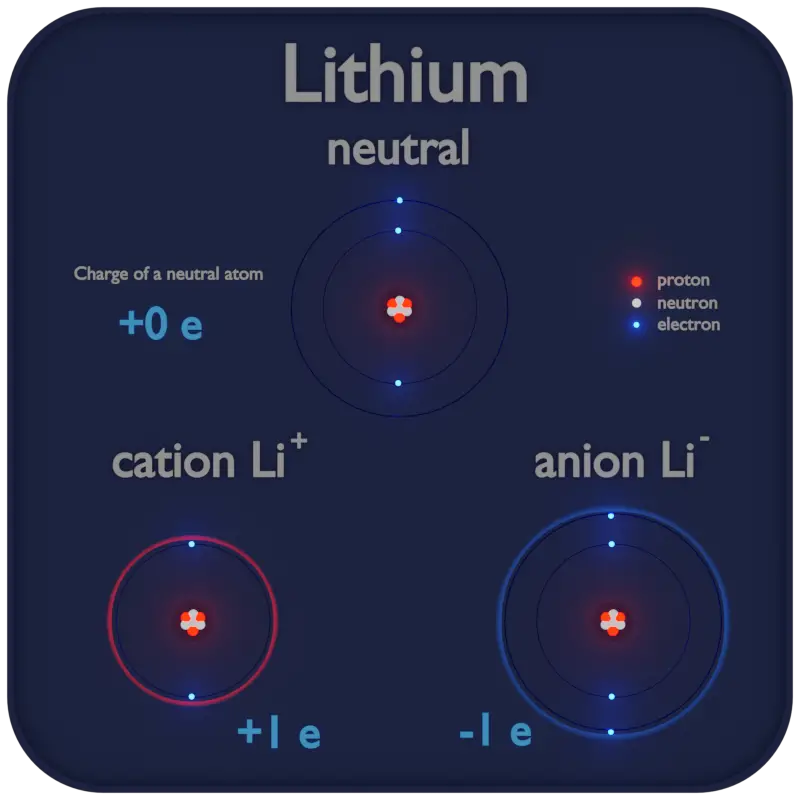
Un atomo è costituito da un nucleo caricato positivamente circondato da elettroni carichi negativamente in modo che l’atomo nel suo insieme sia elettricamente neutro.
Gli elettroni in un atomo sono attratti dai protoni nel nucleo dalla forza elettromagnetica . Questa forza lega gli elettroni all’interno di un pozzo di potenziale elettrostatico che circonda il nucleo più piccolo, il che significa che è necessaria una fonte di energia esterna per la fuga dell’elettrone.

A proposito di cariche elettriche negli atomi
Cos’è l’elettricità? L’elettricità è definita come “il flusso di elettroni attraverso materiali e dispositivi semplici” o “quella forza che muove gli elettroni”. Gli scienziati pensano che l’elettricità sia prodotta da particelle molto piccole chiamate elettroni e protoni . Queste particelle sono troppo piccole per essere viste, ma esistono come particelle subatomiche nell’atomo. Per capire come esistono, devi prima capire la struttura dell’atomo.
Il mondo fisico è composto da combinazioni di varie particelle subatomiche o fondamentali . Questi sono i più piccoli elementi costitutivi della materia . Gli atomi sono definiti come i più piccoli costituenti della materia ordinaria, che possono essere divisi senza il rilascio di particelle caricate elettricamente. Un atomo è costituito da un nucleo caricato positivamente circondato da elettroni carichi negativamente in modo che l’atomo nel suo insieme sia elettricamente neutro. Il protone trasporta una singola unità di carica positiva uguale in grandezza alla carica dell’elettrone. Il neutrone è leggermente più pesante del protone ed è elettricamente neutro, come suggerisce il nome.
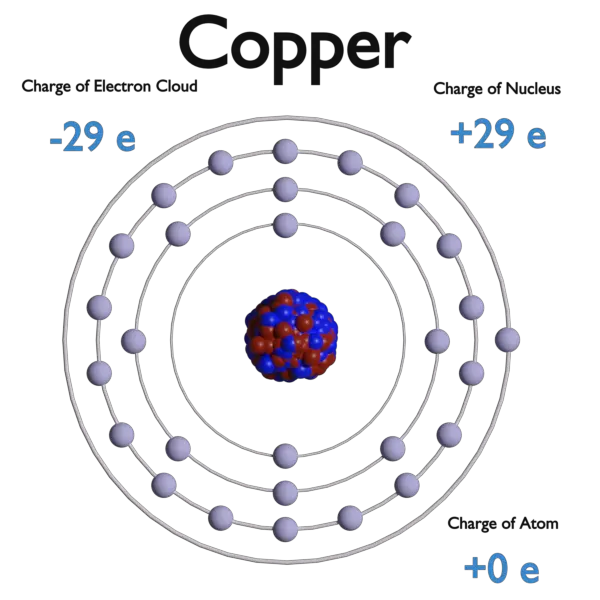
Un elettrone , simbolo e−, è una delle particelle fondamentali che compongono la materia. Gli elettroni sono caricati negativamente (-1e), particelle quasi prive di massa che tuttavia rappresentano la maggior parte delle dimensioni dell’atomo. La loro massa a riposo è pari a 9.109 × 10-31 kg ( 510.998 keV/c2 ) (circa 1/1836 di quella del protone). Gli elettroni si trovano in una nuvola di elettroni, che è l’area che circonda il nucleo dell’atomo. Il modello della nuvola di elettroni è un modello di un atomo, in cui l’atomo è costituito da un nucleo piccolo ma massiccio circondato da una nuvola di elettroni in rapido movimento. Il modello della nuvola di elettroni afferma che non possiamo sapere esattamente dove si trova un elettrone in un dato momento, ma è più probabile che gli elettroni si trovino in aree specifiche. Il modello della nuvola di elettroni definisce la zona di probabilità che descrive la posizione dell’elettrone, a causa del principio di indeterminazione.
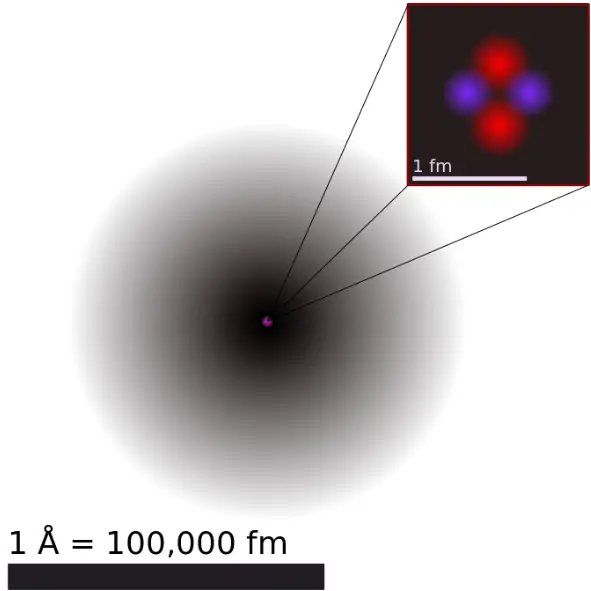
Gli elettroni in un atomo sono attratti dai protoni nel nucleo dalla forza elettromagnetica. Questa forza lega gli elettroni all’interno di un pozzo di potenziale elettrostatico che circonda il nucleo più piccolo, il che significa che è necessaria una fonte di energia esterna per la fuga dell’elettrone.
A volte un atomo può perdere uno o più dei suoi elettroni o può guadagnare elettroni extra, nel qual caso avrà una carica netta positiva o negativa ed è chiamato ione.
Domande frequenti
Le proprietà chimiche dell’atomo sono determinate dal numero di protoni, infatti, dal numero e dalla disposizione degli elettroni. La configurazione di questi elettroni segue i principi della meccanica quantistica. Il numero di elettroni nei gusci di elettroni di ciascun elemento, in particolare il guscio di valenza più esterno, è il fattore principale che determina il suo comportamento di legame chimico.
Un atomo è costituito da un nucleo caricato positivamente circondato da elettroni carichi negativamente in modo che l’atomo nel suo insieme sia elettricamente neutro. Il nucleo atomico è costituito da protoni carichi positivamente e neutroni neutri.
Gli elettroni in un atomo sono attratti dai protoni nel nucleo dalla forza elettromagnetica. Questa forza lega gli elettroni all’interno di un pozzo di potenziale elettrostatico che circonda il nucleo più piccolo, il che significa che è necessaria una fonte di energia esterna per la fuga dell’elettrone.