30-Sekunden-Zusammenfassung
Elektrische Ladungen in Atomen
Elektrische Ladungen in Atomen werden von Protonen und Elektronen getragen.
Die Atome sind definiert als die kleinsten Bestandteile gewöhnlicher Materie, die geteilt werden können, ohne dass elektrisch geladene Teilchen freigesetzt werden.
Ein Atom besteht aus einem positiv geladenen Kern, der von negativ geladenen Elektronen umgeben ist, so dass das Atom als Ganzes elektrisch neutral ist.
Die Elektronen in einem Atom werden durch die elektromagnetische Kraft von den Protonen im Atomkern angezogen. Diese Kraft bindet die Elektronen in einem elektrostatischen Potentialtopf, der den kleineren Kern umgibt, was bedeutet, dass eine externe Energiequelle benötigt wird, damit das Elektron entweichen kann.

Über elektrische Ladungen in Atomen
Was ist Strom? Elektrizität wird definiert als „der Fluss von Elektronen durch einfache Materialien und Geräte“ oder „die Kraft, die Elektronen bewegt“. Wissenschaftler glauben, dass Elektrizität von sehr kleinen Teilchen erzeugt wird, die Elektronen und Protonen genannt werden. Diese Teilchen sind zu klein, um gesehen zu werden, existieren aber als subatomare Teilchen im Atom. Um zu verstehen, wie sie existieren, müssen Sie zuerst die Struktur des Atoms verstehen.
Die physische Welt besteht aus Kombinationen verschiedener subatomarer oder fundamentaler Teilchen . Dies sind die kleinsten Bausteine der Materie . Die Atome sind definiert als die kleinsten Bestandteile gewöhnlicher Materie, die geteilt werden können, ohne dass elektrisch geladene Teilchen freigesetzt werden. Ein Atom besteht aus einem positiv geladenen Kern, der von negativ geladenen Elektronen umgeben ist, so dass das Atom als Ganzes elektrisch neutral ist. Das Proton trägt eine einzelne positive Einheitsladung, deren Größe der Elektronenladung entspricht. Das Neutron ist etwas schwerer als das Proton und ist, wie der Name schon sagt, elektrisch neutral.
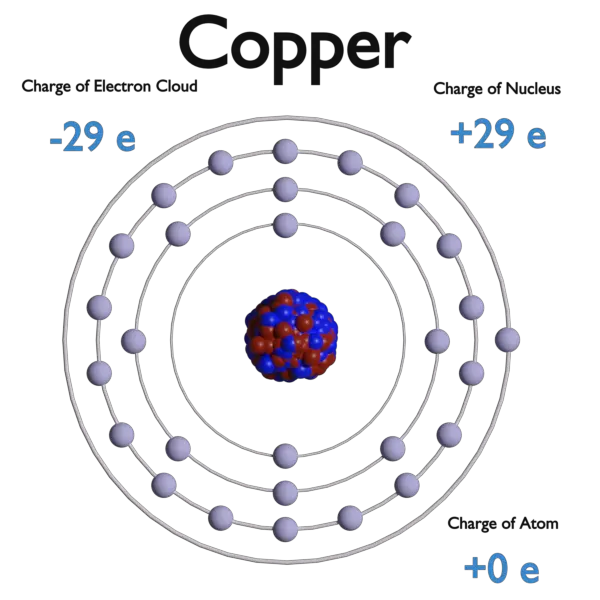
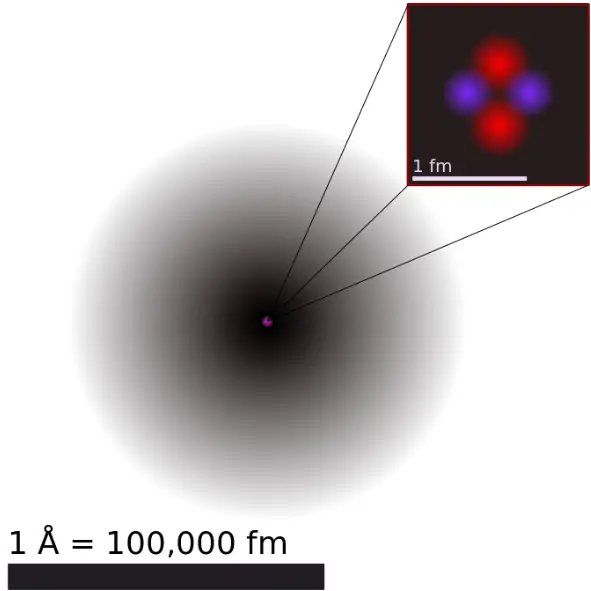
Ein Elektron , Symbol e−, ist eines der fundamentalen Teilchen, aus denen Materie besteht. Die Elektronen sind negativ geladene (-1e), fast masselose Teilchen, die dennoch den größten Teil der Größe des Atoms ausmachen. Ihre Ruhemasse beträgt 9,109 × 10−31 kg ( 510,998 keV/c2 ) (etwa 1/1836 der des Protons). Elektronen befinden sich in einer Elektronenwolke, der Umgebung des Atomkerns. Das Elektronenwolkenmodell ist ein Modell eines Atoms, bei dem das Atom aus einem kleinen, aber massiven Kern besteht, der von einer Wolke sich schnell bewegender Elektronen umgeben ist. Das Elektronenwolkenmodell besagt, dass wir nicht genau wissen können, wo sich ein Elektron zu einem bestimmten Zeitpunkt befindet, aber die Elektronen befinden sich eher in bestimmten Bereichen. Das Elektronenwolkenmodell definiert aufgrund des Unsicherheitsprinzips die Wahrscheinlichkeitszone, die den Ort des Elektrons beschreibt.
Die Elektronen in einem Atom werden durch die elektromagnetische Kraft von den Protonen im Kern angezogen. Diese Kraft bindet die Elektronen in einem elektrostatischen Potentialtopf, der den kleineren Kern umgibt, was bedeutet, dass eine externe Energiequelle benötigt wird, damit das Elektron entweichen kann.
Manchmal kann ein Atom ein oder mehrere seiner Elektronen verlieren oder zusätzliche Elektronen gewinnen, in diesem Fall hat es eine positive oder negative Nettoladung und wird als Ion bezeichnet.
Häufig gestellte Fragen
Die chemischen Eigenschaften des Atoms werden durch die Anzahl der Protonen bestimmt, genauer gesagt durch die Anzahl und Anordnung der Elektronen. Die Konfiguration dieser Elektronen folgt den Prinzipien der Quantenmechanik. Die Anzahl der Elektronen in den Elektronenschalen jedes Elements, insbesondere der äußersten Valenzschale, ist der Hauptfaktor, der sein chemisches Bindungsverhalten bestimmt.
Ein Atom besteht aus einem positiv geladenen Kern, der von negativ geladenen Elektronen umgeben ist, so dass das Atom als Ganzes elektrisch neutral ist. Der Atomkern besteht aus positiv geladenen Protonen und neutralen Neutronen.
Die Elektronen in einem Atom werden durch die elektromagnetische Kraft von den Protonen im Kern angezogen. Diese Kraft bindet die Elektronen in einem elektrostatischen Potentialtopf, der den kleineren Kern umgibt, was bedeutet, dass eine externe Energiequelle benötigt wird, damit das Elektron entweichen kann.



