Princípio de Funcionamento das Baterias
O Processo Eletroquímico Básico
As baterias operam com base no princípio fundamental das células eletroquímicas, onde reações redox espontâneas ocorrem em dois eletrodos separados por um eletrólito. Este eletrólito é uma substância condutora iônica e isolante elétrica. A energia química é armazenada em metais de alta energia, como Zn ou Li, que não são estabilizados por ligações de d-elétrons, diferentemente dos metais de transição. Todas as baterias, apesar da diversidade de tipos e combinações de materiais, operam com base no mesmo princípio de reação de oxidação-redução.
Design e Funcionamento das Baterias
Baterias são projetadas para que a reação redox energeticamente favorável ocorra somente quando os elétrons se movem através da parte externa do circuito. Em termos simples, cada bateria é projetada para manter o cátodo e o ânodo separados, prevenindo uma reação imediata. Os elétrons armazenados fluirão apenas quando o circuito estiver fechado, ou seja, quando a bateria for colocada em um dispositivo e este for ligado. As baterias são essencialmente fontes de energia elétrica contínua (DC), convertendo energia química armazenada em energia elétrica através de um processo eletroquímico.
Composição e Variedade de Materiais
Existem diversas composições de materiais usados em baterias, resultando em diferentes capacidades e comportamentos. Os materiais mais comuns incluem chumbo, níquel e lítio, cada um com diferentes saídas de energia e especificidades para diferentes aplicações. Por exemplo, as baterias de íon de lítio possuem alta capacidade específica (3.86 Ah/g) e um potencial de eletrodo extremamente baixo (−3.04 V contra eletrodo padrão de hidrogênio), tornando o lítio um material ideal para baterias de alta tensão e energia.
Reações Redox nas Baterias
Em uma célula eletroquímica, reações redox espontâneas resultam em uma mudança nos estados de oxidação dos átomos envolvidos. Os elétrons são transferidos de um elemento para outro, oxidando o ânodo (perda de elétrons) e reduzindo o cátodo (ganho de elétrons). A reação redox típica em uma célula Daniell, por exemplo, envolve eletrodos de Zn e Cu, cada um em contato com uma solução de seu próprio íon. O resultado dessas reações é o acúmulo de cobre sólido no cátodo e a corrosão do eletrodo de zinco na solução como cátions de zinco.
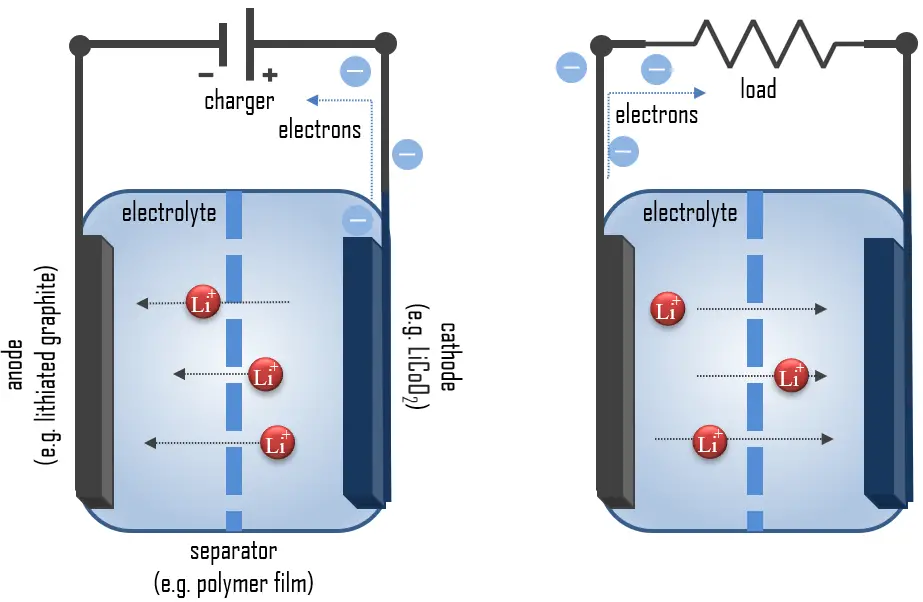
Princípio de Operação das Baterias de Íon de Lítio
As baterias de íon de lítio funcionam através da oxidação do lítio no ânodo de grafite-lítio, gerando íons de lítio que migram através do eletrólito até o cátodo, onde são incorporados ao óxido de cobalto de lítio. Essas reações podem ser revertidas para recarregar a célula, com os íons de lítio deixando o cátodo e migrando de volta para o ânodo. A reação global (descarga à esquerda, carga à direita) é representada por: C6Li + CoO2 ⇄ C6 + LiCoO2.