니켈-금속수소전지(NiMH): 원리와 특성
니켈-금속수소전지(NiMH)는 재충전이 가능한 배터리로서, 양극은 니켈 수산화물로, 음극은 수소를 흡수하는 합금(금속수소)으로 구성되어 있다. 1989년 상업적으로 출시된 이 배터리는 처음에는 휴대용 개인용 컴퓨터의 전원으로 주로 사용되었다. 이후 NiMH 배터리 시스템은 전기 하이브리드 차량에 널리 사용되며, 재충전 가능한 배터리 시장의 10%를 차지하게 되었다.
니켈-금속수소전지(NiMH)와 니켈-카드뮴전지(NiCd)의 비교
NiMH 배터리는 NiCd 배터리에 비해 40% 높은 비에너지를 제공하여 약 두 배의 용량을 가진다. 또한 전압 감소에 덜 민감하고, 유독한 카드뮴이 없다는 것이 큰 장점이다. NiMH 배터리는 니켈-카드뮴 배터리보다 메모리 효과가 훨씬 적다.
NiMH 배터리의 화학적 구성
NiMH 전지는 다음과 같은 구성 요소를 포함한다:
양극(Cathode): 니켈(III) 산화-수산화물 양극판
음극(Anode): 금속수소(수소 흡수 합금)
분리막(Separator)
전해질(Electrolyte): 알칼리성 전해질(수산화칼륨)
NiMH 전지의 음극에 사용되는 금속 M은 금속간 화합물이다. 이를 위한 다양한 화합물이 개발되었으며, 연구는 주로 AB5, AB2, AB 합금 계열에 집중되었다. 여기서 A는 수소에 강한 친화력을 가진 금속 원소(란타넘, 세륨, 네오디뮴, 프라세오디뮴 등의 희토류 원소), B는 수소 친화력이 약한 금속 원소(니켈, 코발트, 망간, 알루미늄 등의 전이 금속)를 나타낸다.
AB5 합금의 중요성
오늘날 가장 다재다능하고 상업적으로 중요한 가역 수소화 합금 계열은 AB5 금속간 화합물이다. 전극 목적으로 최적의 구성은 다음과 같은 합금이다: MmNi3.55Mn0.4Al0.3Co0.75. 여기서 Mm은 희토류 원소의 합금인 미쉬메탈로, 대략 55% 세륨, 25% 란타넘, 15~18% 네오디뮴 및 기타 희토류 금속의 흔적을 포함한다.
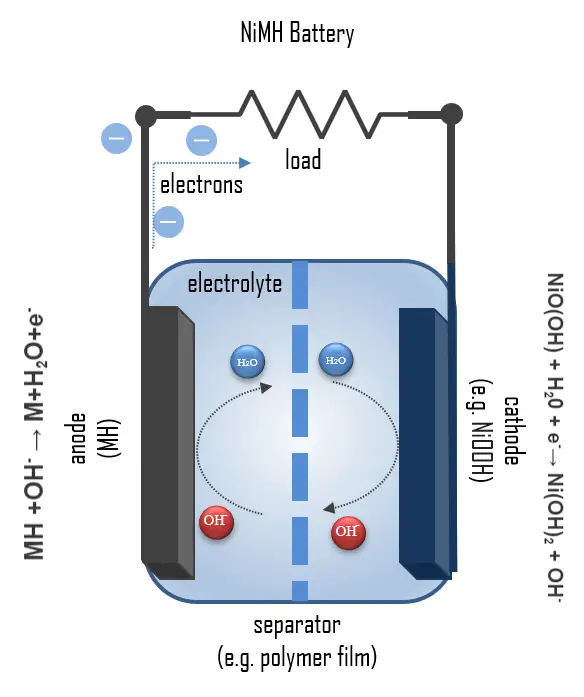
NiMH 전지의 구조와 방전 과정
NiMH 원통형 전지의 층 구조는 다음과 같다: 외부에 천공된 호일이 음극인 금속수소 분말을 담는 운반체로 사용된다. 방전 시, 금속수소 MH에 결합된 수소는 산화되어 양성자가 되며, 금속의 0 산화 상태가 형성된다:
MH + OH– → M + H2O + e–
이때 생성된 양성자는 KOH 용액의 OH– 이온과 반응하여 물을 형성한다. 산화환원 전위는 대략 -0.83V이다. 분리막은 20% KOH 용액을 담은 전해질을 보유하고 양극과의 직접적인 접촉을 방지한다. 양극은 니켈 수산화물과 니켈 산화수화물의 시트로 구성된다. 여기서 산화 상태 +III의 니켈은 반응에서 산화 상태 +II로 환원된다:
NiO(OH) + H2O + e– → Ni(OH)2 + OH–
방전 과정 동안의 전체 반응은 다음과 같다:
NiO(OH) + MH → Ni(OH)2 + M
이 과정에서 자유 전자가 결합되어 이 극이 양극이 된다. 환원의 산화환원 전압은 대략 0.49V이다. 따라서 산화환원 반응의 총 전압은 E0 = 0.49V – (-0.83V) = 1.32V이다. NiMH 전지의 비에너지는 약 80Wh/kg으로, 알칼라인 전지와 거의 같고 NiCd 배터리보다 두 배 이상 높다.
NiMH 배터리의 사용 주의점
NiMH 배터리는 과충전, 과열, 잘못된 극성, 그리고 심한 방전에 민감하다.