Batteria al Nichel-Metallo Idruro: Funzionamento e Caratteristiche
Introduzione e Storia
La batteria al nichel-metallo idruro (NiMH) è una batteria ricaricabile introdotta commercialmente nel 1989. Essa presenta un elettrodo positivo in idrossido di nichel e un elettrodo negativo in idruro metallico, una lega in grado di assorbire idrogeno. Originariamente usata nei computer portatili, questa tecnologia si è affermata nei veicoli elettrici ibridi, rappresentando il 10% del mercato totale delle batterie ricaricabili.
Confronto con le Batterie NiCd
Rispetto alle batterie al nichel-cadmio (NiCd), le NiMH offrono una energia specifica superiore del 40%, raddoppiando quasi la capacità. Inoltre, sono meno soggette a depressione di tensione e non contengono il tossico cadmio. Anche l’effetto memoria è significativamente ridotto rispetto alle batterie NiCd.
Composizione Chimica
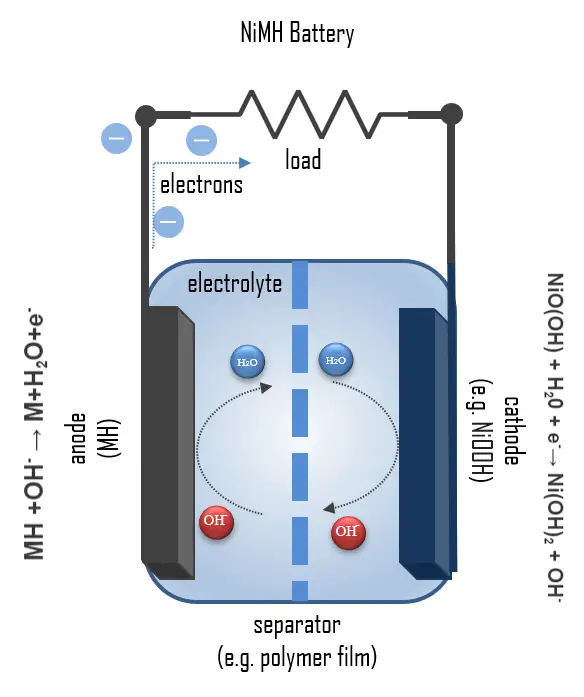
Una cella NiMH tipica contiene:
- Catodo: una piastra di elettrodo positivo in ossido di nichel(III)-idrossido
- Anodo: un idruro metallico (lega assorbente idrogeno)
- Separatore
- Elettrolita: elettrolita alcalino (idrossido di potassio)
Materiali dell’Elettrodo Negativo
L’elettrodo negativo delle batterie Ni/MH è composto da un composto intermetallico, sviluppato in diverse famiglie di leghe: AB5, AB2, e AB. Nella notazione, “A” rappresenta un elemento metallico con forte affinità all’idrogeno (es. lantanio, cerio), mentre “B” un elemento metallico con debole affinità (es. nichel, cobalto). Le leghe AB5 sono le più importanti commercialmente per la loro reversibilità nel formare idruri.
La composizione ottimale per gli scopi elettrodici si trova nell’lega MmNi3.55Mn0.4Al0.3Co0.75, dove Mm è un Mischmetal, una lega di elementi delle terre rare.
Struttura a Strati della Cella NiMH
Una cella cilindrica NiMH è costituita da una lamina perforata esterna che funge da portatore per la polvere di idruro metallico, formando l’elettrodo negativo. Durante lo scarico, l’idrogeno legato nell’idruro metallico MH viene ossidato a protone, formando metalli in stato di ossidazione 0:
MH + OH– → M + H2O + e–
I protoni risultanti reagiscono con gli ioni OH– della soluzione di KOH formando acqua. Il potenziale redox è di circa -0.83 V. Il separatore mantiene l’elettrolita, una soluzione al 20% di KOH, e impedisce il contatto diretto con l’elettrodo positivo.
Reazioni al Catodo
Il catodo è costituito da un foglio di idrossido di nichel e idrato di ossido di nichel. Qui, il nichel in stato di ossidazione +III viene ridotto a nichel in stato di ossidazione +II nella reazione:
NiO(OH) + H2O + e– → Ni(OH)
2 + OH–
Reazione Complessiva Durante lo Scarico
La reazione complessiva durante lo scarico è la seguente:
NiO(OH) + MH → Ni(OH)2 + M
Questo processo lega gli elettroni liberi, rendendo questo polo l’elettrodo positivo. La tensione di riduzione redox è di circa 0.49 V. La tensione totale della reazione redox è quindi E0 = 0.49V – (-0.83V) = 1.32V.
Energia Specifica e Precauzioni d’Uso
L’energia specifica di una cella NiMH è di circa 80 Wh/kg, quasi pari a quella di una cella alcalina e più del doppio di quella di una batteria NiCd. Tuttavia, le batterie NiMH sono sensibili alla sovraccarica, al surriscaldamento, alla polarità errata e alla scarica profonda.
Conclusione
Le batterie al nichel-metallo idruro rappresentano un’importante evoluzione nel campo delle batterie ricaricabili, offrendo capacità elevate, minore impatto ambientale e maggiore versatilità. La loro presenza in applicazioni come i veicoli ibridi evidenzia il loro ruolo cruciale nella tecnologia moderna.