Batterie Nickel-Métal-Hydrure : Fonctionnement et Composition
La batterie nickel-métal-hydrure (NiMH) est une batterie rechargeable introduite commercialement en 1989. Elle est composée d’une électrode positive en hydroxyde de nickel et d’une électrode négative en alliage absorbant l’hydrogène. Les batteries NiMH ont gagné en popularité, surtout dans les véhicules hybrides électriques, représentant 10% du marché total des batteries rechargeables.
Avantages par rapport aux Batteries NiCd
Comparées aux batteries nickel-cadmium (NiCd), les batteries NiMH offrent une énergie spécifique 40% plus élevée, ce qui se traduit par une capacité environ deux fois plus grande. Elles sont moins affectées par la dépression de tension et ne contiennent pas de cadmium toxique. De plus, l’effet mémoire des batteries NiMH est bien moindre que celui des batteries NiCd.
Chimie de la Batterie Nickel-Métal-Hydrure
Une cellule typique de NiMH contient :
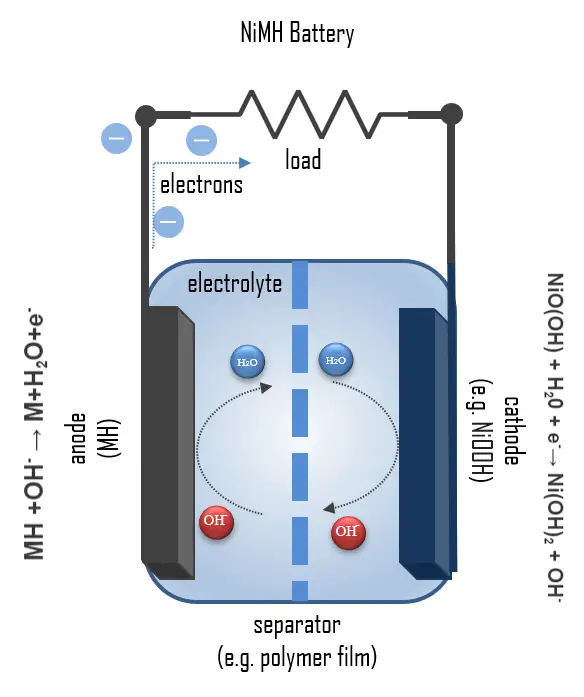
- Cathode : une plaque d’électrode positive en oxyde-hydroxyde de nickel(III)
- Anode : un hydride métallique (alliage absorbant l’hydrogène)
- Séparateur
- Électrolyte : un électrolyte alcalin (hydroxyde de potassium)
Le composant métallique de l’électrode négative dans une cellule NiMH est un composé intermétallique. Plusieurs familles d’alliages ont été développées pour cette application, notamment les familles AB5, AB2 et AB. Dans cette notation, « A » représente un élément métallique ayant une forte affinité pour l’hydrogène (typiquement un élément des terres rares comme le lanthane, le cérium, le néodyme ou le praséodyme) et « B » un élément métallique ayant une faible affinité pour l’hydrogène (généralement un métal de transition comme le nickel, le cobalt, le manganèse ou l’aluminium).
Les matériaux hydridogènes basés sur les intermétalliques AB5 sont aujourd’hui les plus importants et les plus polyvalents. La composition optimale pour les électrodes a été trouvée pour un alliage de la forme : MmNi3.55Mn0.4Al0.3Co0.75, où Mm est un Mischmetal, un alliage d’éléments des terres rares.
Structure et Réactions Chimiques
La structure en couches d’une cellule ronde NiMH est complexe. Un feuillard perforé externe sert de support pour la poudre d’hydride métallique, formant l’électrode négative. Pendant la décharge, l’hydrogène lié dans l’hydride métallique MH est oxydé en proton, formant un métal à l’état d’oxydation 0 :
MH + OH– → M + H2O + e–
Les protons résultants réagissent avec les ions hydroxyde OH– de la solution de KOH pour former de l’eau. Le potentiel redox est d’environ -0.83 V.
La cathode se compose d’une feuille d’hydroxyde et d’hydrate d’oxyde de nickel. Ici, le nickel à l’état d’oxydation +III est réduit en nickel à l’état d’oxydation +II :
NiO(OH) + H2O + e– → Ni(OH)2 + OH–
La réaction globale pendant la décharge est donc :
NiO(OH) + MH → Ni(OH)2 + M
Ce processus génère des électrons libres, faisant de ce pôle l’électrode positive. La tension totale de la réaction redox est E0 = 0.49V – (-0.83V) = 1.32V.
Performances et Limitations
La densité énergétique spécifique d’une cellule NiMH est d’environ 80 Wh/kg, presque aussi élevée que celle d’une cellule alcaline et plus de deux fois supérieure à celle d’une batterie NiCd. Cependant, les batteries NiMH sont sensibles à la surcharge, à la surchauffe, à la polarité incorrecte et à la décharge profonde.