Principes de Fonctionnement des Batteries
Les batteries, éléments indispensables de notre quotidien, fonctionnent sur le principe des cellules électrochimiques. Au cœur de ce processus se trouve la réaction redox spontanée, se déroulant entre deux électrodes séparées par un électrolyte. Cet électrolyte, conducteur ionique mais électriquement isolant, permet le transfert d’électrons tout en empêchant le contact direct entre les électrodes.
La capacité de stockage d’énergie chimique dans des métaux à haute énergie, tels que le zinc (Zn) ou le lithium (Li), s’explique par l’absence de liaison d’électrons d, contrairement aux métaux de transition. Cette particularité confère à ces métaux une grande réactivité chimique, utilisée dans la conception des batteries.
Le Fonctionnement d’une Batterie
Toutes les batteries, malgré la diversité de leurs matériaux, fonctionnent selon le même principe de réaction d’oxydoréduction. Elles sont conçues pour que la réaction redox, favorable sur le plan énergétique, ne se produise que lorsque les électrons se déplacent à travers la partie externe du circuit. Ainsi, la cathode et l’anode sont maintenues séparées afin d’éviter une réaction spontanée.
Lorsqu’un circuit est fermé, par exemple en allumant un appareil, les électrons stockés s’écoulent. C’est cette circulation d’électrons qui constitue l’électricité. La batterie transforme donc l’énergie chimique stockée en énergie électrique via un processus électrochimique, fournissant une force électromotrice pour les courants dans les circuits électriques et électroniques.
Exemple de Réaction dans les Batteries
Considérons la cellule Daniell, composée de deux électrodes de métaux différents (Zn et Cu), chacune en contact avec une solution de son propre ion (sulfate de zinc et sulfate de cuivre, respectivement). La réaction redox se déroulant dans cette cellule est un exemple classique :
Zn → Zn2+ + 2e– (Oxydation à l’anode)
Cu2+ + 2e– → Cu (Réduction à la cathode)
Ces processus entraînent l’accumulation de cuivre solide sur la cathode et la corrosion de l’électrode de zinc dans la solution. Les électrons produits par l’oxydation du zinc sont poussés hors de l’anode (électrode négative), traversent le fil et sont attirés dans la cathode de cuivre où ils participent à la réduction des ions cuivre.
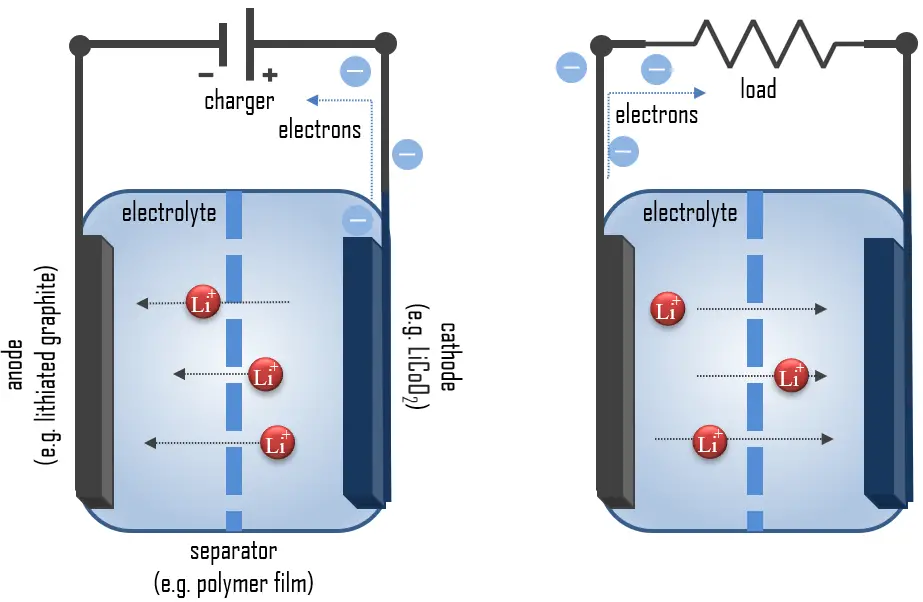
Principe de Fonctionnement des Batteries au Lithium-ion
Le lithium, métal le plus léger, est idéal pour les batteries haute tension et haute énergie en raison de sa grande capacité spécifique (3.86 Ah/g) et de son potentiel d’électrode extrêmement bas (-3.04 V par rapport à l’électrode standard à hydrogène). Lors de la décharge, le lithium est oxydé de Li à Li+ (état d’oxydation de 0 à +1) dans l’anode en graphite de lithium à travers la réaction :
C6Li → 6C(graphite) + Li+ + e–
Les ions lithium migrent à travers l’électrolyte vers la cathode, où ils sont incorporés dans l’oxyde de cobalt lithium à travers la réaction suivante, réduisant le cobalt d’un état d’oxydation de +4 à +3 :
CoO2 (s) + Li+ + e– → LiCoO2 (s)
En résumé, les batteries incarnent une technologie fascinante et complexe, exploitant les réactions chimiques pour la conversion de l’énergie. Leur évolution continue répond aux besoins croissants en énergie de notre société moderne.