Principios de Funcionamiento de la Batería
En el corazón de cada batería, ya sea de zinc, litio o cualquier otro tipo, se encuentra el principio de la celda electroquímica. Esta celda es fundamental para entender cómo funcionan las baterías, un dispositivo omnipresente en nuestra vida diaria. La operación de una batería se basa en reacciones redox espontáneas, es decir, reacciones de oxidación-reducción, que ocurren en dos electrodos separados por un electrolito. Este electrolito es una sustancia conductiva iónica y eléctricamente aislante.
Electrodos y Electrolitos
Los electrodos, comúnmente hechos de metales como el zinc (Zn) o el litio (Li), no están estabilizados por enlaces de electrones d, a diferencia de los metales de transición. Esto les confiere una alta capacidad para almacenar energía química. En cualquier tipo de batería, independientemente de sus materiales, se utiliza el mismo principio de reacción de oxidación-reducción.
Funcionamiento de la Batería
El diseño de las baterías permite que la reacción redox energéticamente favorable ocurra solo cuando los electrones se mueven a través de la parte externa del circuito. En términos simples, la batería mantiene separados el cátodo y el ánodo para evitar una reacción directa. Los electrones almacenados solo fluyen cuando el circuito se cierra, lo que sucede cuando la batería se coloca en un dispositivo y este se enciende.
Conversión de Energía Química a Eléctrica
Una batería eléctrica es, esencialmente, una fuente de energía eléctrica de corriente continua. Convierte la energía química almacenada en energía eléctrica a través de un proceso electroquímico, proporcionando una fuerza electromotriz que permite el flujo de corrientes en circuitos eléctricos y electrónicos. Una batería típica consta de una o más celdas voltaicas.
Materiales Comunes en Baterías
Las baterías están compuestas de una amplia gama de materiales, lo que resulta en diferentes capacidades y comportamientos en su funcionalidad. Los más comunes son el plomo, el níquel y el litio, cada uno con diferentes salidas y específicos para diversos propósitos, dependiendo de los requisitos.
Reacción Química en Baterías
Cuando el circuito se cierra, la atracción más fuerte por los electrones en el cátodo (por ejemplo, dióxido de manganeso en baterías alcalinas) atrae los electrones del ánodo (por ejemplo, zinc) a través del cable en el circuito hacia el electrodo del cátodo. Esta reacción química de la batería, este flujo de electrones a través del cable, es electricidad.
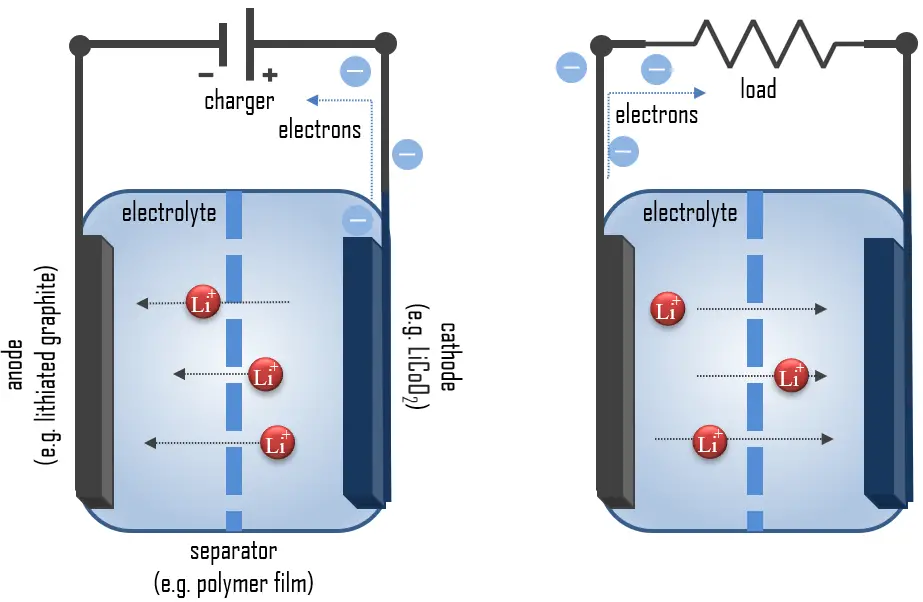
Principio de Operación de las Baterías de Iones de Litio
El metal de litio, el más ligero y con una alta capacidad específica (3.86 Ah/g) y un potencial de electrodo extremadamente bajo (-3.04 V vs. electrodo estándar de hidrógeno), es ideal para baterías de alto voltaje y alta energía. Durante la descarga, el litio se oxida de Li a Li+ en el ánodo de grafito-litio a través de la reacción:
C6Li → 6C(grafito) + Li+ + e–
Estos iones de litio migran a través del medio electrolítico hasta el cátodo, donde se incorporan en óxido de cobalto de litio, reduciendo el cobalto de un estado de oxidación +4 a +3:
CoO2 (s) + Li+ + e– → LiCoO2 (s)
Estas reacciones se pueden revertir para recargar la celda. En este caso, los iones de litio dejan el cátodo de cobalto de litio y migran de vuelta al ánodo, donde se reducen a litio neutro e incorporan de nuevo en la red de grafito.
Conclusión
Comprender el principio de funcionamiento de las baterías nos ofrece una visión clara de su importancia en la tecnología moderna. Desde dispositivos móviles hasta vehículos eléctricos, la batería sigue siendo un componente crucial en la fuente de energía eléctrica, impulsando nuestra vida cotidiana hacia un futuro más sostenible y eficiente.