Principio di Funzionamento delle Batterie
Il principio fondamentale di una cella elettrochimica è basato sulle reazioni redox spontanee che avvengono in due elettrodi separati da un elettrolita, una sostanza conduttiva ionica e isolante elettrica. L’energia chimica può essere immagazzinata, per esempio, in metalli ad alta energia come Zn o Li, che non sono stabilizzati dal legame con elettroni d come i metalli di transizione. Sebbene esista un’ampia gamma di tipi di batterie con diverse combinazioni di materiali, tutte utilizzano il medesimo principio della reazione di ossidoriduzione.
Funzionamento Energetico delle Batterie
Le batterie sono progettate in modo che la reazione redox energeticamente favorevole possa verificarsi solo quando gli elettroni si muovono attraverso la parte esterna del circuito. In termini semplici, ogni batteria è progettata per mantenere separati catodo e anodo al fine di prevenire una reazione diretta. Gli elettroni immagazzinati fluiscono solo quando il circuito si chiude, ad esempio quando la batteria viene inserita in un dispositivo e il dispositivo viene acceso.
Conversione dell’Energia nelle Batterie
Una batteria elettrica è essenzialmente una fonte di energia elettrica in corrente continua. Converte l’energia chimica immagazzinata in energia elettrica attraverso un processo elettrochimico, fornendo così una forza elettromotrice per permettere il flusso di correnti nei circuiti elettrici ed elettronici. Una batteria tipica è composta da una o più celle voltaiche.
Reazioni Redox nelle Batterie
Nella cella elettrochimica, le reazioni redox spontanee si svolgono in due elettrodi separati da un elettrolita. La reazione redox è una reazione chimica che produce un cambiamento negli stati di ossidazione degli atomi coinvolti. Gli elettroni vengono trasferiti da un elemento all’altro. Di conseguenza, l’elemento donatore, che è l’anodo, viene ossidato (perde elettroni) e l’elemento ricevente, il catodo, viene ridotto (guadagna elettroni).
Il Caso della Cella di Daniell
Ad esempio, la cella di Daniell è costituita da due elettrodi di metalli dissimili, Zn e Cu; ogni elettrodo è a contatto con una soluzione del proprio ione; solfato di zinco e solfato di rame rispettivamente. La reazione redox che si verifica nella cella di Daniell è:
Zn (s) → Zn2+ (aq) + 2e–
Cu2+ (aq) + 2e– → Cu (s)
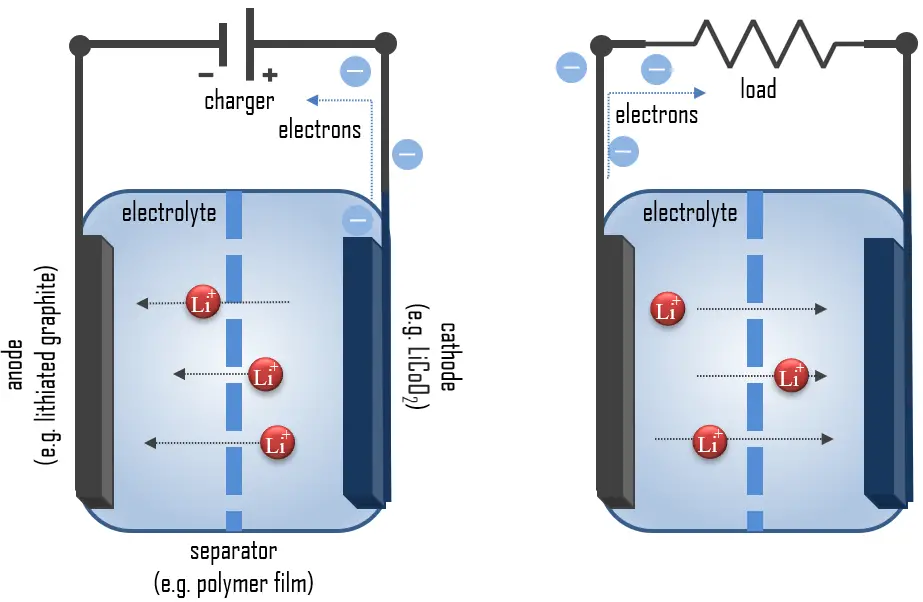
Principio di Funzionamento delle Batterie al Litio
Il litio è il metallo più leggero e possiede un’alta capacità specifica (3.86 Ah/g) e un potenziale elettrodo estremamente basso (−3.04 V rispetto all’elettrodo standard a idrogeno). Pertanto, il litio è un materiale anodico ideale per batterie ad alta tensione ed alta energia. Durante la scarica, il litio viene ossidato da Li a Li+ (stato di ossidazione da 0 a +1) nell’anodo di litio-grafite attraverso la reazione:
C6Li → 6C(grafite) + Li+ + e–
Questi ioni di litio migrano attraverso il mezzo elettrolitico verso il catodo, dove vengono incorporati nell’ossido di cobalto di litio attraverso la seguente reazione, che riduce il cobalto da uno stato di ossidazione +4 a +3:
CoO2 (s) + Li+ + e– → LiCoO2 (s)
Ecco la reazione completa (da sinistra a destra = scarica, da destra a sinistra = carica):
C6Li + CoO2 ⇄ C6 + LiCoO2