Chimie des Batteries Électriques
Le principe fondamental d’une cellule électrochimique repose sur des réactions redox spontanées se produisant dans deux électrodes, séparées par un électrolyte. Cet électrolyte est une substance conductrice ionique et électriquement isolante. La capacité de stocker l’énergie chimique, par exemple dans le zinc (Zn) ou le lithium (Li), provient de leur nature de métaux à haute énergie. Ces métaux ne sont pas stabilisés par la liaison avec des électrons d, contrairement aux métaux de transition.
Malgré l’existence d’une grande variété de batteries, avec différentes combinaisons de matériaux, toutes suivent le même principe de réaction d’oxydoréduction. Les batteries sont conçues pour que la réaction redox, énergétiquement favorable, ne se produise que lorsque les électrons se déplacent à travers la partie externe du circuit.
Fonctionnement et Composants Clés
En termes simples, chaque batterie est conçue pour maintenir séparés la cathode et l’anode, empêchant ainsi une réaction directe. Les électrons stockés ne circulent que lorsque le circuit est fermé, c’est-à-dire lorsque la batterie est placée dans un appareil et que cet appareil est allumé. Une batterie électrique est essentiellement une source d’énergie électrique continue, convertissant l’énergie chimique stockée en énergie électrique par un processus électrochimique.
Une batterie typique est composée d’une ou plusieurs cellules voltaïques. Lorsque le circuit est fermé, l’attraction plus forte des électrons par la cathode (par exemple, le dioxyde de manganèse dans les piles alcalines) entraîne les électrons de l’anode (par exemple, le zinc) à travers le fil dans le circuit vers l’électrode de la cathode. Ce flux d’électrons est ce que nous appelons l’électricité.
La Cellule de Daniell
La cellule de Daniell, par exemple, est constituée de deux électrodes de métaux différents, le zinc et le cuivre, chacune en contact avec une solution de son propre ion; sulfate de zinc et sulfate de cuivre respectivement. La réaction redox qui se produit dans la cellule de Daniell est un exemple classique illustrant ces principes.
Chimie des Batteries au Lithium-Ion
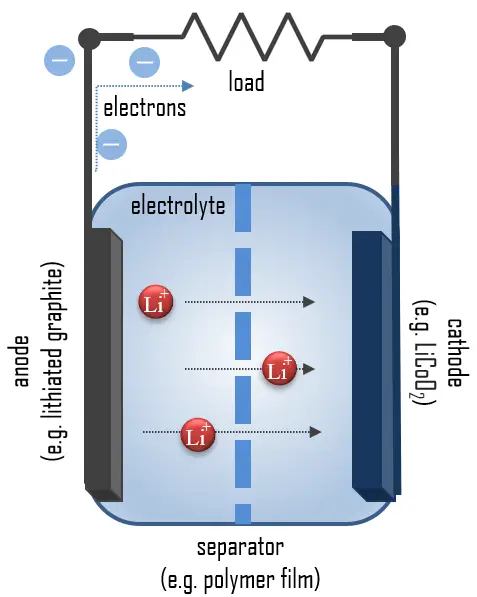
Le lithium, le métal le plus léger, possède une capacité spécifique élevée (3,86 Ah/g) et un potentiel d’électrode extrêmement bas (−3,04 V par rapport à l’électrode standard à hydrogène), ce qui en fait un matériau d’anode idéal pour des batteries à haute tension et à haute énergie. Pendant la décharge, le lithium est oxydé de Li à Li+ dans l’anode en graphite de lithium à travers la réaction suivante : C6Li → 6C(graphite) + Li+ + e−.
Ces ions lithium migrent à travers le milieu électrolytique vers la cathode, où ils sont incorporés dans l’oxyde de cobalt lithium à travers la réaction suivante, qui réduit le cobalt d’un état d’oxydation de +4 à +3 : CoO2(s) + Li+ + e− → LiCoO2(s).
Voici la réaction complète (de gauche à droite = décharge, de droite à gauche = charge) : C6Li + CoO2 ⇄ C6 + LiCoO2. Ces réactions peuvent être inversées pour recharger la cellule.
Les batteries sont fabriquées à partir d’une vaste gamme de matériaux, ce qui entraîne différentes capacités et comportements dans la fonctionnalité de la batterie. Les matériaux les plus courants sont le plomb, le nickel et le lithium, chacun avec des sorties différentes et spécifiques pour différents usages en fonction des exigences.