Chimica delle Batterie Elettriche
Le batterie elettriche sono dispositivi fondamentali nel nostro mondo tecnologico, svolgendo un ruolo cruciale in una vasta gamma di applicazioni, dalla telefonia mobile ai veicoli elettrici. La chimica delle batterie elettriche è un campo affascinante e complesso, che coinvolge reazioni redox spontanee in elettrodi separati da un elettrolita.
Principio Fondamentale delle Celle Elettrochimiche
Il principio fondamentale di una cella elettrochimica si basa sulle reazioni redox spontanee che avvengono in due elettrodi separati da un elettrolita. Quest’ultimo è una sostanza conduttiva ionica e isolante dal punto di vista elettrico. L’energia chimica può essere immagazzinata, ad esempio, in metalli ad alta energia come lo Zn o il Li, che non sono stabilizzati dal legame con gli elettroni d come i metalli di transizione.
Diversità e Principio Comune nelle Batterie
Nonostante l’esistenza di una vasta gamma di tipi di batterie con diverse combinazioni di materiali, tutte utilizzano lo stesso principio della reazione di ossidoriduzione. Le batterie sono progettate in modo che la reazione redox energeticamente favorevole possa verificarsi solo quando gli elettroni si muovono attraverso la parte esterna del circuito. In termini semplici, ogni batteria è progettata per mantenere separati catodo e anodo al fine di prevenire una reazione diretta. Gli elettroni immagazzinati fluiscono solo quando il circuito si chiude, ovvero quando la batteria viene inserita in un dispositivo e quest’ultimo viene acceso.
Funzionamento di una Batteria
Una batteria elettrica è essenzialmente una fonte di energia elettrica in corrente continua. Converte l’energia chimica immagazzinata in energia elettrica attraverso un processo elettrochimico, fornendo così una forza elettromotrice per consentire il flusso di corrente nei circuiti elettrici ed elettronici. Una batteria tipica è composta da una o più celle voltaiche.
Tipi Comuni di Batterie e Loro Uso
Le batterie sono realizzate con una vasta gamma di materiali, risultando in diverse capacità e comportamenti nella funzionalità della batteria. I tipi più comuni sono il piombo, il nichel e il litio, ognuno con diverse uscite e specifici per diversi scopi a seconda delle esigenze.
La Reazione Chimica in una Batteria
Quando il circuito si chiude, l’attrazione maggiore per gli elettroni da parte del catodo (ad esempio, biossido di manganese nelle batterie alcaline) attira gli elettroni dall’anodo (ad esempio, zinco) attraverso il filo nel circuito verso l’elettrodo del catodo. Questo flusso di elettroni attraverso il filo è l’elettricità.
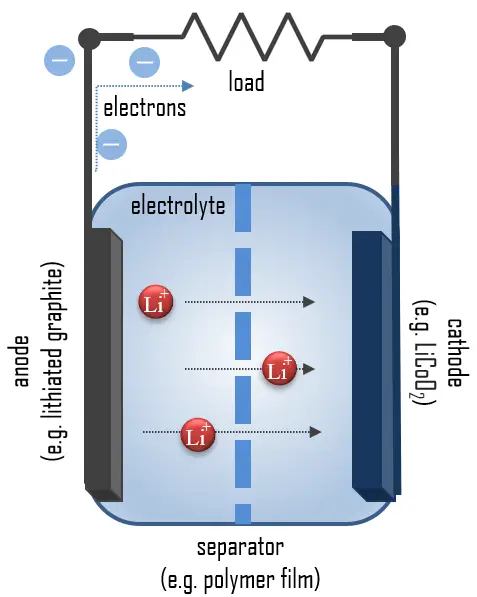
Chimica delle Batterie agli Ioni di Litio
Il litio è il metallo più leggero e possiede una capacità specifica elevata (3.86 Ah/g) e un potenziale elettrodo estremamente basso (−3.04 V rispetto all’elettrodo standard a idrogeno), rendendolo un materiale anodico ideale per batterie ad alta tensione e ad alta energia. Durante la scarica, il litio nell’anodo di grafite-litio viene ossidato da Li a Li+ e migra attraverso l’elettrolita al catodo, dove viene incorporato nell’ossido di litio e cobalto, riducendo lo stato di ossidazione del cobalto da +4 a +3.
Queste reazioni sono reversibili, permettendo la ricarica della cella. In questo caso, gli ioni di litio lasciano il catodo di ossido di litio e cobalto e migrano di nuovo all’anodo, dove vengono ridotti a litio neutro e reincorporati nella rete di grafite.
Conclusione
In conclusione, la chimica delle batterie elettriche è un campo in continua evoluzione, con ricerche che puntano a migliorare la capacità, la durata e la sostenibilità di queste tecnologie essenziali. La comprensione dei principi fondamentali e dei materiali coinvolti è fondamentale per lo sviluppo di soluzioni di stoccaggio dell’energia più efficienti e ambientalmente sostenibili.