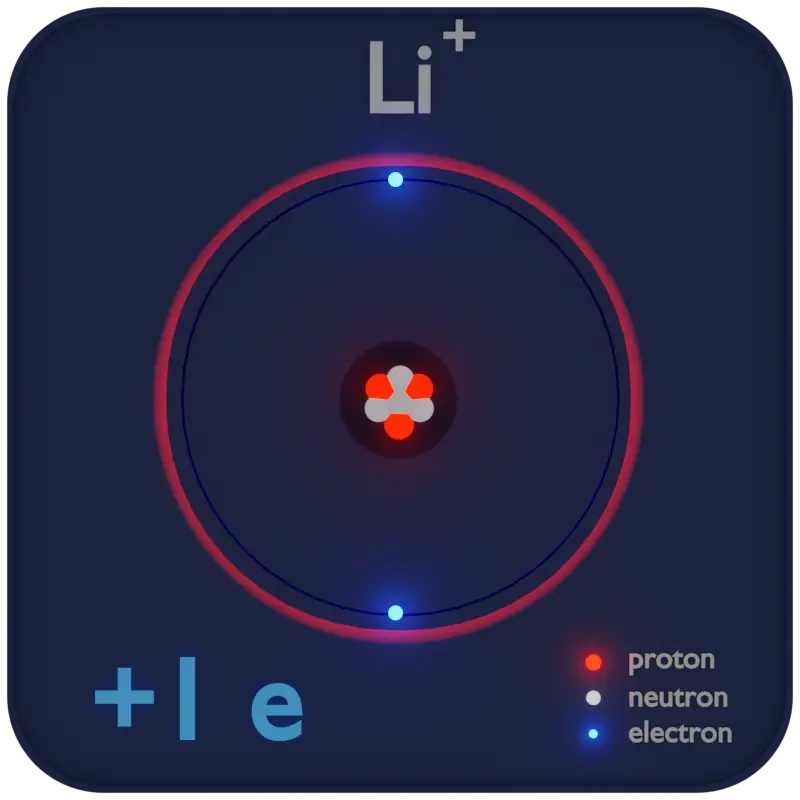
Les Cations : Atomes Chargés Positivement
Un ion est un atome ou une molécule qui a perdu ou gagné un ou plusieurs de ses électrons, lui conférant ainsi une charge électrique nette. Les ions peuvent être de deux types : cations et anions. Dans cet article, nous nous concentrerons sur les cations, qui sont des ions chargés positivement.
Qu’est-ce qu’un Cation ?
Un cation est un ion avec une charge positive, résultant d’un déficit en électrons par rapport aux protons. Cette charge positive est due à la perte d’un ou plusieurs électrons, les éléments négatifs qui orbitent autour du noyau atomique. Le nombre de protons (chargés positivement) dans le noyau devient alors supérieur au nombre d’électrons, créant une charge nette positive.
Caractéristiques des Cations
Les cations sont généralement plus petits que leurs atomes neutres correspondants. La raison en est que les électrons de valence, qui sont les plus éloignés du noyau, sont perdus. La taille d’un cation est typiquement inférieure à 10−10 m (10−8 cm) en rayon. Cette petite taille affecte leurs propriétés chimiques et physiques.
Formation des Cations
La formation des cations implique la perte d’électrons. Les électrons dans un atome sont attirés par les protons dans le noyau grâce à la force électromagnétique. Cette force maintient les électrons dans un puits de potentiel électrostatique autour du noyau. Pour qu’un électron s’échappe, une source d’énergie externe est nécessaire. Ce processus se produit généralement lors des réactions chimiques où les atomes perdent des électrons et deviennent des cations.
Rôles et Importance des Cations
Les cations jouent un rôle crucial dans de nombreux phénomènes naturels et applications industrielles. Ils sont essentiels dans la formation des liaisons ioniques, où les ions de charges opposées (cations et anions) s’attirent mutuellement. Ces liaisons sont fondamentales dans la formation de nombreux composés chimiques, notamment les sels.
Interaction entre Cations et Anions
Les particules portant la même charge électrique se repoussent, tandis que celles de charges opposées s’attirent. Cette attraction entre cations et anions conduit à la formation de structures cristallines stables, comme le sel de table (chlorure de sodium), où chaque ion sodium (Na+) est entouré par des ions chlorure (Cl−).
Conclusion
En résumé, les cations sont des ions chargés positivement essentiels à la chimie et à la physique. Leur formation, par la perte d’électrons, et leur interaction avec les anions sont au cœur de nombreux processus chimiques. Ces petites particules jouent un rôle gigantesque dans notre compréhension du monde à l’échelle moléculaire.