Autobatterie – Automobilbatterie
Die Autobatterie, auch bekannt als SLI-Batterie (Starten, Beleuchten, Zünden), ist eine wiederaufladbare Batterie, die zum Starten von Kraftfahrzeugen verwendet wird. Ihre Hauptaufgabe besteht darin, einen elektrischen Strom für den elektrisch betriebenen Starter zu liefern, der wiederum den chemisch betriebenen Verbrennungsmotor startet, der das Fahrzeug antreibt. Sobald der Motor läuft, wird die Stromversorgung der elektrischen Systeme des Autos weiterhin von der Batterie bereitgestellt, wobei die Lichtmaschine die Batterie je nach Bedarf lädt oder entlädt.
Design und Funktionsweise
Autobatterien sind darauf ausgelegt, in kurzer Zeit maximalen Strom zu liefern und dabei die Spannung konstant zu halten. Dies wird durch eine sehr geringe innere Widerstandsfähigkeit erreicht. Diese Batterien haben eine gute Lebensdauer unter Bedingungen geringer Zyklentiefe, aber eine sehr begrenzte Lebensdauer bei tiefer Entladung (etwa 12-15 Zyklen). Aktuelle Entladungen können bei starken Temperaturänderungen auftreten, weshalb Gewicht, Design und Form charakteristisch sind. Sie werden häufig zum Starten von Autos sowie Diesel- und Benzin-Fahrzeugen verwendet.
Aufbau und Chemie der Autobatterie
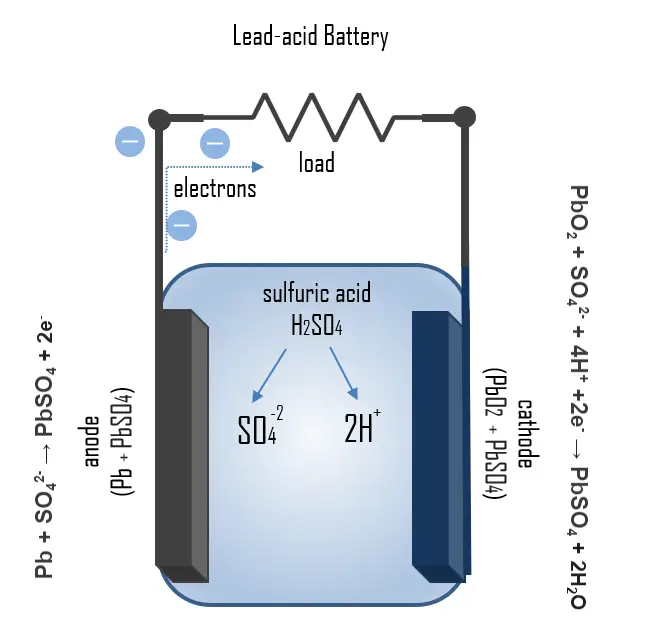
Die meisten Autobatterien sind Blei-Säure-Batterien, bestehend aus einem Gehäuse, zwei Bleiplatten oder -gruppen, wobei eine als positive und die andere als negative Elektrode dient, sowie einer Füllung aus 37% Schwefelsäure (H2SO4) als Elektrolyt. Die Batterie enthält flüssigen Elektrolyt in einem unversiegelten Behälter, was erfordert, dass sie aufrecht gehalten und gut belüftet wird, um eine sichere Verbreitung des bei Überladung erzeugten Wasserstoffgases zu gewährleisten. Blei-Säure-Batterien haben typischerweise koulometrische Wirkungsgrade von 85% und Energieeffizienzen in der Größenordnung von 70%.
Chemische Reaktionen in der Autobatterie
Die Funktionsweise der Autobatterie lässt sich durch die chemischen Prozesse, die während des Ladens und Entladens stattfinden, veranschaulichen. Beim Entladen findet am Anodenprozess Pb + SO42- → PbSO4 + 2e– statt. Blei wird mit dem Elektrolyt zu Bleisulfat oxidiert, wobei zwei Elektronen freigesetzt werden. Bleisulfat wird auch an der Kathode gebildet durch: PbO2 + SO42- + 4H+ +2e– → PbSO4 + 2H2O. In dieser Reaktion findet eine Reduktion von Bleioxid statt. Das gebildete Bleisulfat lagert sich als Beschichtung auf den Elektroden ab und zu einem gewissen Grad auch am Boden des Gehäuses. Da Schwefelsäure während des Entladeprozesses verbraucht wird, kann der Ladezustand (SoC) durch Messung der Dichte des Elektrolyten bestimmt werden.
Der Ladevorgang
Beim Laden kehren sich die Prozesse um, sodass das während der Entladung gebildete Bleisulfat zu Blei und reduziertem Bleioxid oxidiert wird. Wenn das Bleisulfat vollständig verbraucht ist und der Ladevorgang nicht gestoppt wird, beginnt die Elektrolyse des Elektrolyten. Überladung mit hohen Ladespannungen erzeugt Sauerstoff- und Wasserstoffgas durch Elektrolyse von Wasser, das aufsteigt und verloren geht. Versiegelte Batterien haben Katalysatoren (Pd, Pt) über dem Lüftungsschacht, wo Sauerstoffwasserstoffgas zu Wasser rekombinieren kann. Die resultierende Zellspannung kann aus der galvanischen Reihe bestimmt werden. Die Gesamtspannung der Redoxreaktion beträgt somit: E0 = 1.68V – ( – 0.36V) = 2.04V. Eine gängige Spannung für Autobatterien beträgt 12 Volt (DC). Diese Batterie besteht jedoch aus sechs 2V-Blei-Zellen.
Fazit
Die Autobatterie ist ein wesentlicher Bestandteil jedes Fahrzeugs, da sie für das Starten des Motors und die Stromversorgung verschiedener elektrischer Systeme verantwortlich ist. Ihr Verständnis und ihre Wartung sind für die Langlebigkeit und Zuverlässigkeit des Fahrzeugs von entscheidender Bedeutung.