O Funcionamento da Bateria de Carro
A bateria de um carro, também conhecida como bateria automotiva, é um componente recarregável essencial para a partida de veículos motorizados. Conhecida como bateria SLI, esta sigla refere-se às funções de partida (Starting), iluminação (Lighting) e ignição (Ignition) do veículo. O principal papel da bateria é fornecer corrente elétrica ao motor de partida, que, por sua vez, ativa o motor de combustão interna responsável pelo movimento do veículo.
Uma vez que o motor está em funcionamento, a bateria continua fornecendo energia para os sistemas elétricos do carro. O alternador, por sua vez, carrega a bateria conforme a demanda aumenta ou diminui. As baterias de carro são projetadas para entregar corrente máxima em um curto período de tempo, mantendo a voltagem constante e apresentando baixa resistência interna. Apesar de terem uma boa vida útil em condições de ciclos superficiais, elas possuem uma vida útil muito menor sob ciclos profundos (cerca de 12-15 ciclos).
Composição e Química da Bateria
A maioria das baterias de carro são do tipo chumbo-ácido e consistem em um invólucro, duas placas de chumbo ou grupos de placas, sendo uma delas o eletrodo positivo e a outra o eletrodo negativo, e um preenchimento de ácido sulfúrico a 37% como eletrólito. Este tipo de bateria contém eletrólito líquido em um recipiente não selado, exigindo que seja mantida na vertical e em área bem ventilada para dispersar com segurança o gás hidrogênio produzido durante o sobrecarregamento.
As baterias de chumbo-ácido têm eficiências coulômbicas de cerca de 85% e eficiências energéticas na ordem de 70%. O chumbo e o dióxido de chumbo, materiais ativos nas placas da bateria, reagem com o ácido sulfúrico no eletrólito para formar sulfato de chumbo. Esse sulfato de chumbo se forma inicialmente em um estado amorfo e finamente dividido, revertendo facilmente para chumbo, dióxido de chumbo e ácido sulfúrico quando a bateria é recarregada.
Processo Químico Durante o Uso
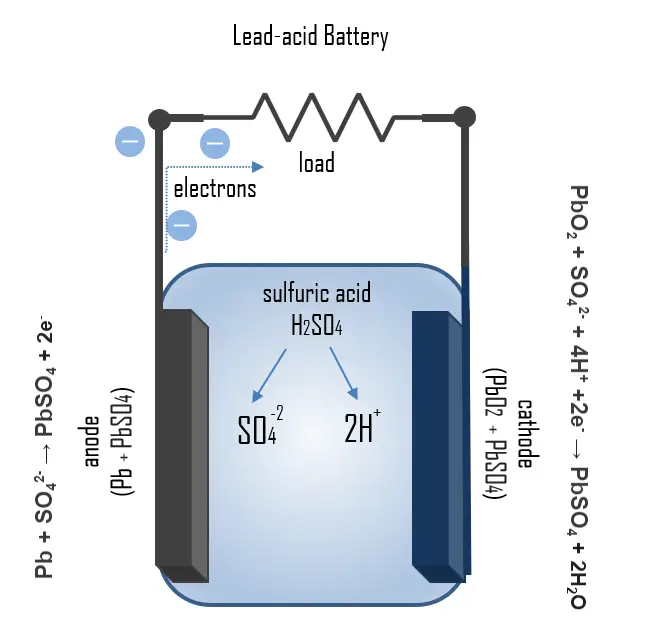
O princípio de funcionamento da bateria de carro pode ser ilustrado pelos processos químicos que ocorrem durante o carregamento e a descarga. Durante a descarga, ocorre o processo Pb + SO42- → PbSO4 + 2e– no ânodo, onde o chumbo é oxidado com o eletrólito para formar sulfato de chumbo, liberando dois elétrons. No cátodo, o sulfato de chumbo também é formado pela reação: PbO2 + SO42- + 4H+ +2e– → PbSO4 + 2H2O, mas nesta reação ocorre a redução do óxido de chumbo.
Durante o carregamento, os processos ocorrem na direção oposta, de modo que o sulfato de chumbo formado durante a descarga é oxidado para chumbo e óxido de chumbo reduzido, respectivamente. Se o sulfato de chumbo for completamente consumido e o processo de carregamento não for interrompido, começa a eletrólise do eletrólito. A sobrecarga com altas voltagens de carregamento gera gás oxigênio e hidrogênio pela eletrólise da água, que borbulha e se perde. Baterias seladas possuem catalisadores (Pd, Pt) acima do respiradouro onde o gás oxihidrogênio pode se recombinar em água. A tensão resultante da célula pode ser determinada a partir da série galvânica. A tensão total da reação redox é, portanto: E0 = 1.68V – ( – 0.36V) = 2.04V. Uma tensão comum para baterias automotivas é de 12 volts (DC), mas essa bateria consiste em seis células de chumbo de 2V.