Bateria de Níquel-Cádmio: Funcionamento e Composição
A bateria de níquel-cádmio (Ni-Cd) é um tipo de bateria secundária que utiliza hidróxido de óxido de níquel Ni(O)(OH) como cátodo e cádmio metálico como ânodo. A sigla Ni-Cd deriva dos símbolos químicos de níquel (Ni) e cádmio (Cd). Esta bateria se destaca pela baixa impedância interna, resultando em uma elevada capacidade de fornecimento de energia, mas com uma capacidade de armazenamento de energia inferior em comparação a outros sistemas de baterias.
Vantagens e Desvantagens
A bateria Ni-Cd possui uma longa vida útil e capacidade de recarga rápida. No entanto, pode sofrer de depressão de tensão ou efeito memória, o que significa que a tensão máxima de carga pode diminuir, e, consequentemente, a capacidade energética, se descarregada continuamente de forma superficial. O maior desvantagem está no conteúdo de cádmio, um metal extremamente tóxico, tornando a Ni-Cd uma opção menos atrativa em sistemas modernos de baterias. Atualmente, seu uso se concentra em dispositivos portáteis de pequeno porte, como ferramentas elétricas, brinquedos, iluminação de emergência, instrumentação médica e produtos industriais portáteis. Seu custo para aplicações de baixa potência é baixo, mas pode ser de três a quatro vezes mais caro do que as baterias de chumbo-ácido para a mesma capacidade.
Química da Bateria de Níquel-Cádmio
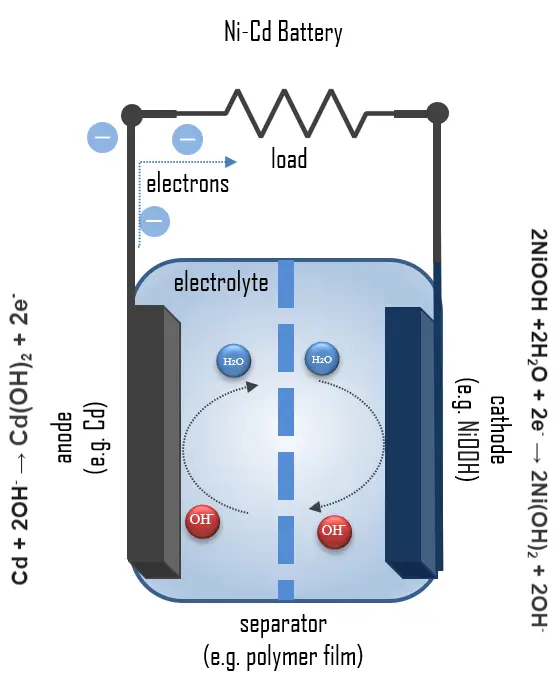
Uma célula Ni-Cd totalmente carregada contém:
- Cátodo: uma placa de eletrodo positivo de óxido-hidróxido de níquel(III).
- Ânodo: uma placa de eletrodo negativo de cádmio.
- Separador.
- Eletrólito: um eletrólito alcalino (hidróxido de potássio).
As baterias Ni-Cd geralmente possuem uma caixa metálica com uma placa de vedação equipada com uma válvula de segurança auto-selante. As placas de eletrodos positivo e negativo, isoladas uma da outra pelo separador, são enroladas em forma espiral dentro da caixa, conhecido como design “jelly-roll”. Esse design permite que uma célula Ni-Cd forneça uma corrente máxima muito maior do que uma célula alcalina de tamanho equivalente.
O eletrodo positivo no estado descarregado é composto por hidróxido de níquel, que foi dopado e modificado para atender aos requisitos da bateria, e grafite como meio condutor. O níquel alterna entre dois estados de oxidação durante a carga e descarga; durante a carga, o hidróxido de níquel é convertido em oxihidróxido de níquel (NiOOH):
2Ni(OH)2 + 2OH– → 2NiOOH + 2 H2O + 2e–
Durante a descarga, as reações no eletrodo de óxido de níquel são:
2NiOOH + 2H2O + 2e– → 2Ni(OH)2 + 2OH–
O eletrodo negativo consiste em hidróxido de cádmio, Cd(OH)2, que é reduzido a cádmio metálico durante a carga. A reação é invertida ao longo do processo de descarga, alterando o estado de oxidação do cádmio de 0 para 2+, liberando dois elétrons por átomo de cádmio que participa da reação. Abaixo está a reação para o ânodo durante a carga:
Cd(OH)2 + 2e– → Cd + 2OH–
As reações químicas no eletrodo de cádmio durante a descarga são:
Cd + 2OH– → Cd(OH)2 + 2e–
A reação geral durante a descarga é:
2NiOOH + Cd + 2H2O → 2Ni(OH)2 + Cd(OH)2
O eletrólito atua como transportador de carga de íons nas baterias, e para as baterias Ni-Cd, isso consiste principalmente em hidróxido de potássio concentrado, KOH, mas também pode ter adições de hidróxido de sódio, NaOH, e hidróxido de lítio, LiOH.
Conclusão
As baterias de níquel-cádmio, apesar de suas limitações e preocupações ambientais, continuam sendo utilizadas em diversas aplicações devido à sua robustez e capacidade de entrega de alta corrente. No entanto, com a crescente preocupação ambiental e o desenvolvimento de tecnologias de baterias mais avançadas e menos prejudiciais ao meio ambiente, seu uso tem se tornado cada vez mais restrito.