니켈-카드뮴 배터리의 작동 원리
니켈-카드뮴 배터리(Ni-Cd 배터리)는 니켈 산화수산화물 Ni(O)(OH)을 양극으로, 금속 카드뮴을 음극으로 사용하는 2차 배터리의 일종입니다. 이 배터리의 약자인 Ni-Cd는 니켈(Ni)과 카드뮴(Cd)의 화학 기호에서 유래합니다. 이 배터리는 낮은 내부 임피던스로 인해 높은 전력을 발휘할 수 있지만, 다른 배터리 시스템에 비해 상대적으로 낮은 에너지 저장 용량을 가지고 있습니다. 또한, 긴 수명과 빠른 재충전 능력을 가지고 있지만, 전압 우울증 혹은 메모리 효과로 인해 지속적으로 얕게 방전될 경우 최대 충전 전압이 감소하여 에너지 용량이 줄어들 수 있습니다. 가장 큰 단점은 카드뮴의 함유입니다. 카드뮴은 매우 유독하기 때문에, Ni-Cd 배터리는 현대 배터리 시스템의 대안이 될 수 없습니다. 현재 Ni-Cd 배터리의 주요 사용처는 전동 공구, 장난감, 비상 조명, 의료 기기, 산업용 휴대용 제품과 같은 소형 휴대용 장치들입니다. 이 배터리는 소형 제품에 사용되는 이유는 저전력 응용 프로그램에 대한 비용이 저렴하지만 같은 용량의 납축 전지보다 3~4배 비싸기 때문입니다.
니켈-카드뮴 배터리의 화학적 구조 및 작동 원리
완전히 충전된 Ni-Cd 셀은 다음과 같은 구성 요소를 가지고 있습니다:
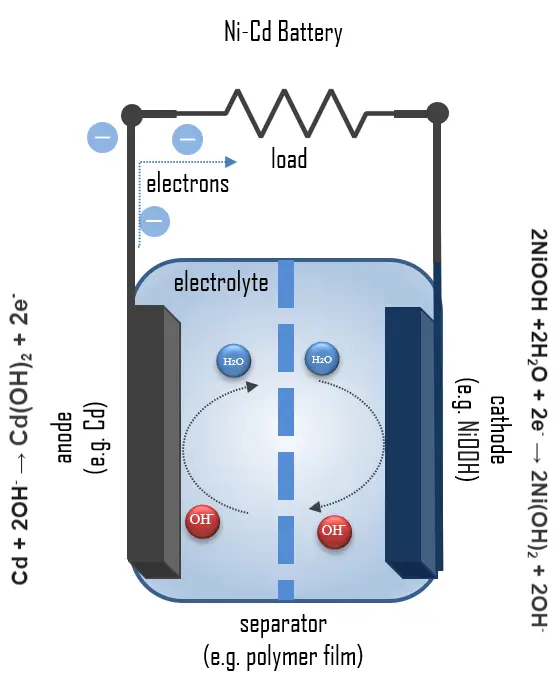
양극: 니켈(III) 산화수산화물 양극 전극 플레이트
음극: 카드뮴 음극 전극 플레이트
분리막
전해질: 알칼리 전해질 (수산화 칼륨)
Ni-Cd 배터리는 일반적으로 금속 케이스로 되어 있으며, 자체 밀봉 안전 밸브가 장착된 밀봉 플레이트로 구성됩니다. 양극과 음극 전극 플레이트는 분리막에 의해 서로 격리되며, 케이스 내부에 나선형으로 감겨 있습니다. 이를 ‘젤리롤 디자인’이라고 하며, 이 구조 덕분에 Ni-Cd 셀은 동일한 크기의 알칼리 셀보다 훨씬 높은 최대 전류를 제공할 수 있습니다. 방전된 상태에서의 양극은 배터리 요구 사항에 맞게 도핑 및 수정된 니켈 수산화물과 전도성 매체로서의 그라파이트로 구성됩니다. 니켈은 충전 및 방전 중에 두 가지 산화 상태 사이에서 순환하며, 충전 시 니켈 수산화물은 니켈 산화수산화물(NiOOH)로 전환됩니다:
2Ni(OH)2 + 2OH– → 2NiOOH + 2H2O + 2e–
방전 중 니켈 산화 전극에서의 반응은 다음과 같습니다:
2NiOOH + 2H2O + 2e– → 2Ni(OH)2 + 2OH–
음극은 카드뮴 수산화물, Cd(OH)2로 구성되어 있으며, 충전 중에 금속 카드뮴으로 환원됩니다. 방전 과정에서 이 반응은 역전되어, 카드뮴의 산화 상태가 0에서 2+로 변하며, 카드뮴 원자당 두 개의 전자를 방출합니다. 충전 중 음극에서의 반응은 다음과 같습니다:
Cd(OH)2 + 2e– → Cd + 2OH–
방전 중 카드뮴 전극에서의 화학 반응은:
Cd + 2OH– → Cd(OH)2 + 2e–
방전 중의 전체 반응은:
2NiOOH + Cd + 2H2O → 2Ni(OH)2 + Cd(OH)2
카드뮴은 그 자체로 상당히 위험한 금속이므로, 전 세계 정부와 EU에서는 카드뮴을 다루는 방법에 대한 일련의 규정과 지침이 마련되어 있습니다. 전해질은 배터리에서 이온 전하 운반체 역할을 하며, Ni-Cd 배터리의 경우 주로 농축된 수산화 칼륨, KOH를 사용하지만 수산화 나트륨, NaOH, 그리고 수산화 리튬, LiOH가 추가될 수도 있습니다.
다음 기사