ニッケル・カドミウム電池の仕組み
ニッケル・カドミウム電池(Ni-Cd電池)は、ニッケル酸化水酸化物Ni(O)(OH)をカソード(陽極)とし、金属カドミウムをアノード(陰極)として使用する二次電池の一種です。Ni-Cdという略称は、ニッケル(Ni)とカドミウム(Cd)の化学記号から来ています。この電池は低内部インピーダンスを持ち、高い電力能力を有していますが、他の電池システムと比較してエネルギー貯蔵容量は低めです。長いサイクル寿命と急速充電の能力を持っていますが、浅い放電が続くと最大充電電圧が低下し、エネルギー容量が減少する「メモリー効果」に悩まされることがあります。
ニッケル・カドミウム電池の最大のデメリット
残念ながら、ニッケル・カドミウム電池の最大の欠点はカドミウムの含有です。カドミウムは非常に有毒な物質であるため、現代の電池システムにおいて代替品とはなり得ません。現在、ニッケル・カドミウム電池の用途は、電動工具、おもちゃ、非常灯、医療機器、または工業用携帯製品などの小型携帯デバイスに限られています。低電力用途に対するコストは安価ですが、同じ容量の鉛酸電池と比較して三~四倍のコストがかかります。
ニッケル・カドミウム電池の化学
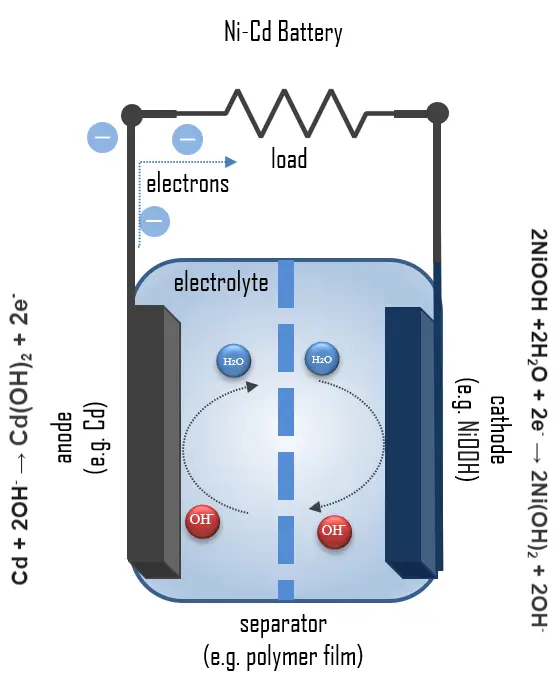
充電されたNi-Cdセルには以下が含まれます:
- カソード:ニッケル(III)酸化水酸化物の正極電極プレート
- アノード:カドミウムの負極電極プレート
- セパレータ
- 電解質:アルカリ性電解質(水酸化カリウム)
Ni-Cd電池は通常、自己封止安全弁を備えた密封プレートと金属ケースを有しています。正極と負極の電極プレートはセパレータによって互いに隔てられ、ケース内で螺旋状に巻かれています。これは「ジェリーロールデザイン」と呼ばれ、同等サイズのアルカリ電池よりもはるかに高い最大電流をNi-Cdセルが供給できる理由です。
充放電時の化学反応
放電状態の正極は、電池要件に合わせてドープされ改良されたニッケル水酸化物と、導電媒体としてのグラファイトで構成されています。ニッケルは充電と放電の間に二つの酸化状態をサイクルします。充電時には、ニッケル水酸化物がニッケルオキシ水酸化物(NiOOH)に変換されます:
2Ni(OH)2 + 2OH- → 2NiOOH + 2H2O + 2e-
放電時のニッケル酸化電極での反応は以下の通りです:
2NiOOH + 2H2O + 2e- → 2Ni(OH)2 + 2OH-
負極は水酸化カドミウム、Cd(OH)2で構成され、充電時に金属カドミウムに還元されます。この反応は放電プロセス中に逆になり、カドミウムの酸化状態が0から2+に変わり、反応に参加するカドミウム原子あたり2つの電子が放出されます。充電時のアノードでの反応は以下の通りです:
Cd(OH)2 + 2e- → Cd + 2OH-
放電時のカドミウム電極での化学反応は以下の通りです:
Cd + 2OH- → Cd(OH)2 + 2e-
放電中の全体的な反応は以下の通りです:
2NiOOH + Cd + 2H2O → 2Ni(OH)2 + Cd(OH)2