La Batterie de Voiture – Un Système Vital Pour Votre Véhicule
Qu’est-ce qu’une Batterie de Voiture?
Une batterie de voiture, également connue sous le nom de batterie SLI (pour démarrage, éclairage et allumage), est une batterie rechargeable essentielle pour le démarrage d’un véhicule à moteur. Sa fonction principale est de fournir un courant électrique au moteur de démarrage électrique, qui démarre à son tour le moteur à combustion interne propulsant le véhicule. Lorsque le moteur fonctionne, la batterie continue d’alimenter les systèmes électriques du véhicule, et l’alternateur charge la batterie en fonction des besoins.
Composition et Fonctionnement
Les batteries de voiture sont généralement des batteries au plomb-acide composées d’un boîtier, de deux plaques de plomb (ou groupes de plaques), l’une positive et l’autre négative, et d’une solution d’acide sulfurique à 37% servant d’électrolyte. Cette batterie contient un électrolyte liquide dans un récipient non scellé, nécessitant une position verticale et une ventilation adéquate pour la dispersion sécurisée du gaz hydrogène produit lors de la surcharge.
Efficacité et Réactions Chimiques
Les batteries au plomb-acide présentent généralement une efficacité coulombique de 85% et une efficacité énergétique de l’ordre de 70%. Le dioxyde de plomb et le plomb, les matériaux actifs des plaques de la batterie, réagissent avec l’acide sulfurique dans l’électrolyte pour former du sulfate de plomb. Lors de la recharge, le sulfate de plomb se reconvertit en plomb, dioxyde de plomb et acide sulfurique.
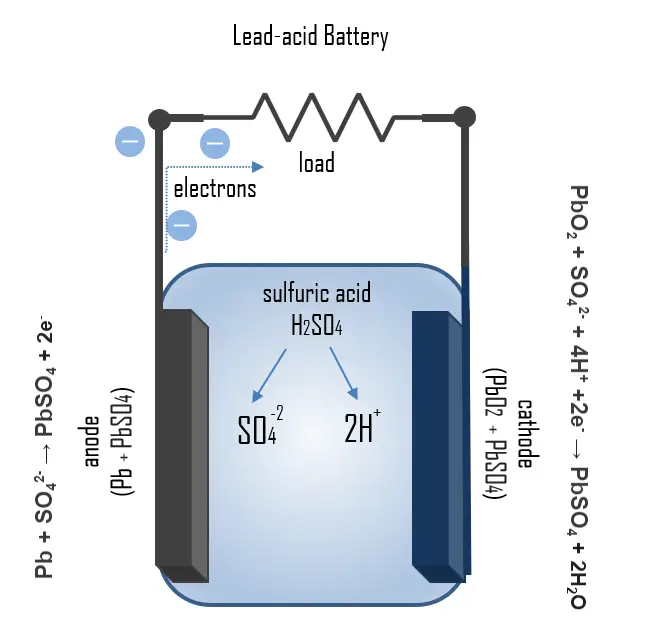
Chimie des Batteries de Voiture
Le principe de fonctionnement de la batterie de voiture peut être illustré par les processus chimiques qui se déroulent pendant la charge et la décharge. Lors de la décharge, le processus Pb + SO42- → PbSO4 + 2e– se produit à l’anode, où le plomb est oxydé avec l’électrolyte en sulfate de plomb, libérant deux électrons. À la cathode, le sulfate de plomb se forme également par la réaction: PbO2 + SO42- + 4H+ + 2e– → PbSO4 + 2H2O, où une réduction de l’oxyde de plomb se produit.
Lors de la charge, ces processus s’inversent, permettant la reconversion du sulfate de plomb en plomb et oxyde de plomb. Si le sulfate de plomb est complètement consommé et le processus de charge non arrêté, l’électrolyse de l’électrolyte commence, générant de l’oxygène et de l’hydrogène.
Voltage et Configuration
La tension totale de la réaction redox est de E0 = 1.68V – (-0.36V) = 2.04V. Une tension commune pour les batteries d’automobile est de 12 volts (CC), mais cette batterie est constituée de six cellules de plomb de 2V chacune.
En résumé, la batterie de voiture est un élément crucial du système électrique d’un véhicule, fournissant l’énergie nécessaire pour démarrer le moteur et alimenter les systèmes électriques pendant le fonctionnement. Sa conception et son fonctionnement chimique sophistiqués garantissent un démarrage fiable et une alimentation constante pour les besoins variés d’un véhicule moderne.