Química de las Baterías Alcalinas
Una batería alcalina, identificada por el código IEC: L, es un tipo de batería primaria que proporciona corriente eléctrica directa a partir de la reacción electroquímica entre el zinc y el dióxido de manganeso (MnO2) en presencia de un electrolito alcalino. Este tipo de batería recibe su nombre por contener un electrolito alcalino de hidróxido de potasio (KOH), en contraste con los electrolitos ácidos de cloruro de amonio (NH4Cl) o cloruro de zinc (ZnCl2) presentes en las baterías de zinc-carbono.
Otros sistemas de baterías también utilizan electrolitos alcalinos, pero difieren en los materiales activos de los electrodos. La batería alcalina primaria es un producto ampliamente utilizado, esencial para alimentar dispositivos portátiles como herramientas eléctricas, radios, juguetes y controles remotos. El tamaño más común de batería alcalina es la conocida batería AA.
Las baterías alcalinas se usan comúnmente en dispositivos portátiles que tienen drenajes de corriente bajos, se utilizan de manera intermitente o se emplean lejos de una fuente de energía alternativa, como en circuitos de alarma y comunicación donde la energía eléctrica solo está disponible de forma intermitente.
Funcionamiento Químico de las Baterías Alcalinas
En términos sencillos, cada batería está diseñada para mantener separados el cátodo y el ánodo y prevenir una reacción. Los electrones almacenados solo fluyen cuando el circuito se cierra, lo cual ocurre al colocar la batería en un dispositivo y encenderlo. Cuando el circuito se cierra, la atracción más fuerte por los electrones por parte del cátodo (por ejemplo, dióxido de manganeso en las baterías alcalinas) tira de los electrones del ánodo (por ejemplo, zinc) a través del cable en el circuito hacia el electrodo del cátodo. Esta reacción química de la batería, este flujo de electrones a través del cable, es la electricidad.
Si profundizamos, las baterías convierten la energía química directamente en energía eléctrica. La energía química puede almacenarse, por ejemplo, en Zn o Li, que son metales de alta energía porque no están estabilizados por el enlace de electrones d, a diferencia de los metales de transición.
Aunque existe una amplia gama de tipos de baterías con diferentes combinaciones de materiales, todos utilizan el mismo principio de la reacción de oxidación-reducción. En una celda electroquímica, las reacciones redox espontáneas tienen lugar en dos electrodos separados por un electrolito, que es una sustancia conductora iónica y eléctricamente aislante.
La reacción redox es una reacción química que produce un cambio en los estados de oxidación de los átomos involucrados. Los electrones se transfieren de un elemento a otro. Como resultado, el elemento donante, que es el ánodo, se oxida (pierde electrones), y el elemento receptor, el cátodo, se reduce (gana electrones).
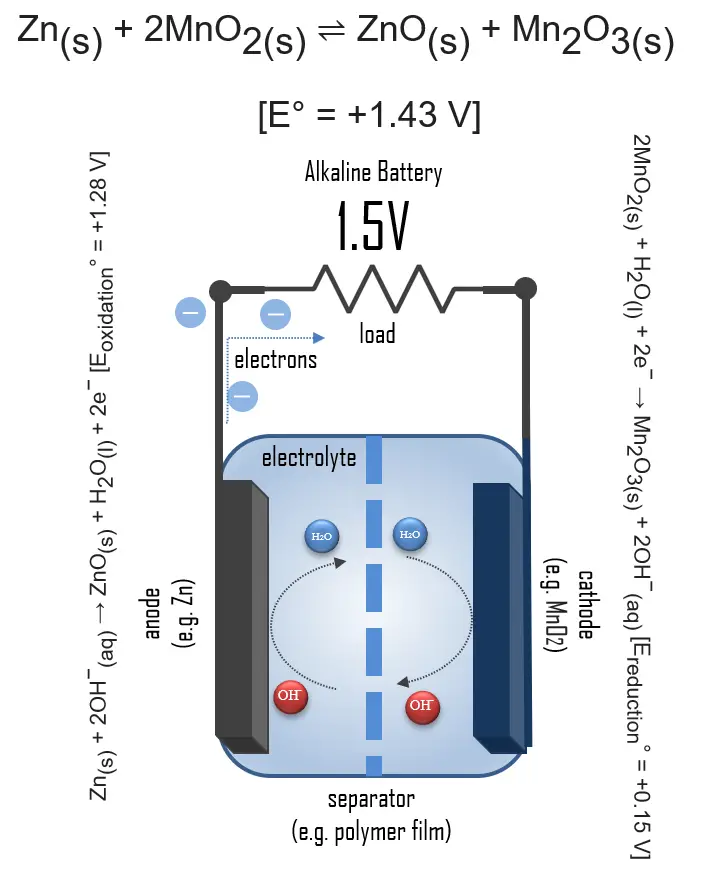
En una batería alcalina, el electrodo negativo es zinc, y el electrodo positivo es dióxido de manganeso de alta densidad (MnO2). El electrolito alcalino de hidróxido de potasio, KOH, no se consume durante la reacción. Solo el zinc y el MnO2 se consumen durante la descarga. El electrolito alcalino de hidróxido de potasio permanece, ya que hay cantidades iguales de OH− consumidas y producidas.
Las reacciones a medias son:
- Zn(s) + 2OH−(aq) → ZnO(s) + H2O(l) + 2e− [Eoxidación° = +1.28 V]
- 2MnO2(s) + H2O(l) + 2e− → Mn2O3(s) + 2OH−(aq) [Ereducción° = +0.15 V]
Reacción general: Zn(s) + 2MnO2(s) ⇌ ZnO(s) + Mn2O3(s) [e° = +1.43 V]
Aplicando esta química de baterías al mundo real, los electrones generados durante la reacción se utilizan para alimentar dispositivos cuando el circuito está cerrado.