Batería de Automóvil: Cómo Funciona
Introducción a la Batería de Automóvil
La batería de automóvil, también conocida como batería SLI (por sus siglas en inglés que significan arranque, iluminación e ignición), es esencial en el funcionamiento de los vehículos motorizados. Su principal función es proporcionar corriente eléctrica al motor de arranque, el cual activa el motor de combustión interna que impulsa el vehículo. Una vez que el motor está en funcionamiento, la batería sigue suministrando energía a los sistemas eléctricos del automóvil. Además, la batería se recarga continuamente a través del alternador, ajustándose a las variaciones en la demanda de energía.
Características y Diseño
Las baterías de automóviles están diseñadas para entregar una corriente máxima en un breve período de tiempo, manteniendo constante el voltaje. Poseen una resistencia interna muy baja, lo que les permite cumplir con esta función de manera eficiente. Estas baterías tienen una buena duración bajo condiciones de ciclos poco profundos, pero su vida útil disminuye significativamente bajo ciclos de descarga profunda, llegando a soportar aproximadamente entre 12 y 15 ciclos. Las variaciones de temperatura durante las descargas de corriente afectan su peso, diseño y forma. Están compuestas principalmente de plomo y ácido sulfúrico, y se utilizan en una amplia gama de vehículos, tanto diésel como gasolina.
Composición y Química
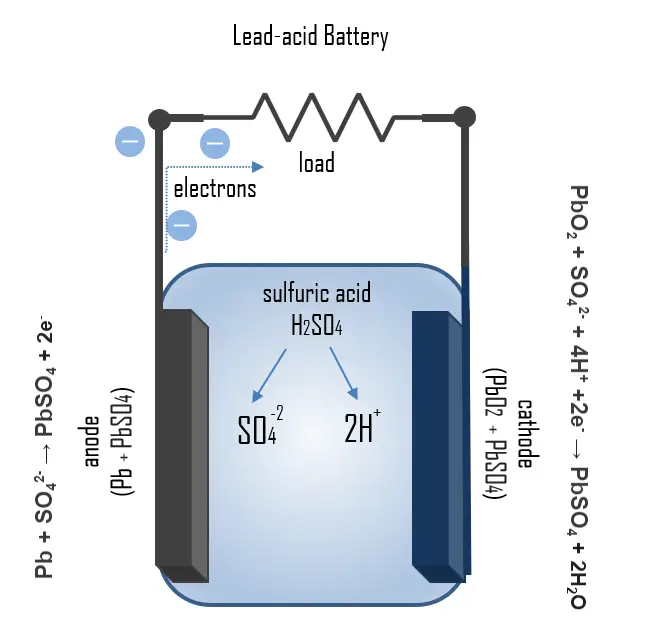
La mayoría de las baterías de coche son baterías de plomo-ácido, que constan de una carcasa, placas de plomo que actúan como electrodos positivos y negativos, y una solución de ácido sulfúrico al 37% como electrolito. Durante el proceso de carga y descarga, los materiales activos en las placas de la batería, plomo y dióxido de plomo, reaccionan con el ácido sulfúrico en el electrolito para formar sulfato de plomo. Esta reacción es reversible, permitiendo que la batería se recargue y reutilice.
Procesos de Carga y Descarga
Durante la descarga, en el ánodo ocurre la reacción: Pb + SO42- → PbSO4 + 2e–, donde el plomo se oxida con el electrolito formando sulfato de plomo y liberando electrones. En el cátodo, el proceso es: PbO2 + SO42- + 4H+ + 2e– → PbSO4 + 2H2O, donde se reduce el óxido de plomo. El sulfato de plomo se deposita en los electrodos y en el fondo de la carcasa. La densidad del electrolito disminuye durante la descarga, lo que permite medir el estado de carga (SoC) de la batería.
En el proceso de carga, las reacciones ocurren en dirección opuesta, regenerando el plomo y el óxido de plomo. Si el sulfato de plomo se consume por completo y la carga no se detiene, comienza la electrólisis del electrolito, generando gases de oxígeno e hidrógeno. Las baterías selladas tienen catalizadores (Pd, Pt) que permiten la recombinación de estos gases en agua.
Voltales y Eficiencia
La eficiencia coulómbica de estas baterías es aproximadamente del 85% y su eficiencia energética ronda el 70%. La tensión total de la reacción redox es: E0 = 1.68V – (-0.36V) = 2.04V. Las baterías de automóviles comunes tienen un voltaje de 12 voltios (DC), compuestas por seis celdas de plomo de 2V cada una.
Conclusión
Las baterías de automóvil son componentes fundamentales en el funcionamiento de los vehículos, proporcionando energía no solo para el arranque sino también para los sistemas eléctricos. Su diseño y composición química les permiten cumplir con estas funciones de manera eficiente, aunque su vida útil varía dependiendo de las condiciones de uso. La comprensión de su funcionamiento y mantenimiento es esencial para garantizar un rendimiento óptimo y una mayor durabilidad del vehículo.