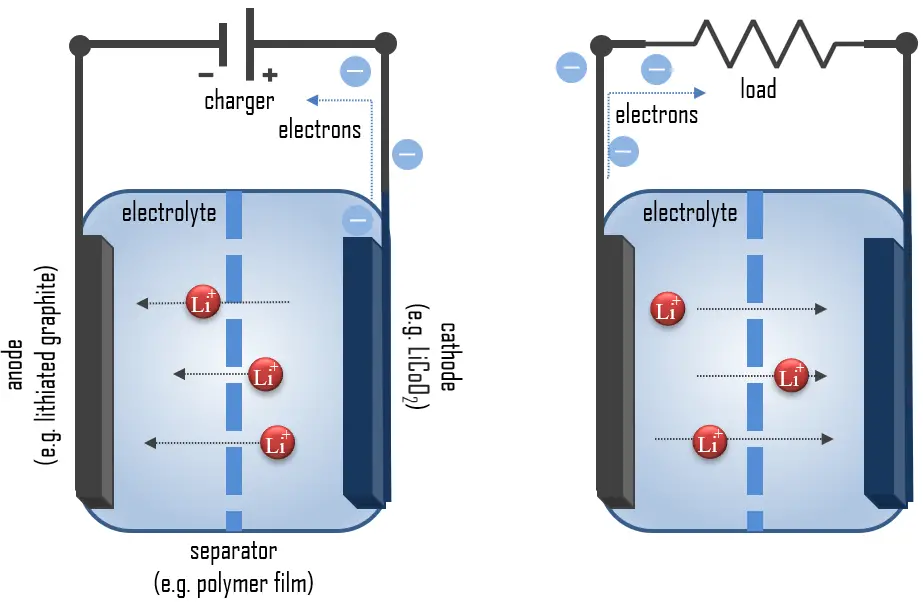
Batterie al Piombo-Acido: Funzionamento e Chimica
Le batterie al piombo-acido sono dispositivi di accumulo elettrico secondari (ricaricabili) costituiti da un contenitore, due gruppi di piastre di piombo, una delle quali funge da elettrodo positivo e l’altra da elettrodo negativo, e un riempimento di acido solforico al 37% (H2SO4) come elettrolita. Queste batterie contengono un elettrolita liquido in un contenitore non sigillato, il che richiede che siano mantenute in posizione verticale e in un’area ben ventilata per garantire una sicura dispersione del gas idrogeno prodotto durante la sovraccarica.
Le batterie al piombo-acido hanno tipicamente efficienze coulombiche dell’85% e efficienze energetiche nell’ordine del 70%. Il piombo e il biossido di piombo, i materiali attivi sulle piastre della batteria, reagiscono con l’acido solforico nell’elettrolita per formare solfato di piombo. Il solfato di piombo si forma inizialmente in uno stato finemente suddiviso e amorfo, e facilmente ritorna a piombo, biossido di piombo e acido solforico quando la batteria si ricarica.
Principio di Funzionamento delle Batterie al Piombo-Acido
Il principio di funzionamento della batteria al piombo-acido può essere illustrato dai processi chimici che avvengono durante la carica e la scarica. Durante la scarica, avviene il processo Pb + SO42- → PbSO4 + 2e– all’anodo. Il piombo viene ossidato dall’elettrolita a solfato di piombo, rilasciando due elettroni. Anche al catodo si forma solfato di piombo per mezzo della reazione PbO2 + SO42- + 4H+ + 2e– → PbSO4 + 2H2O. In questa reazione, avviene una riduzione dell’ossido di piombo. Il solfato di piombo formato si deposita come rivest
imento sulle elettrodi e, in parte, anche sul fondo del contenitore. Poiché l’acido solforico viene utilizzato durante il processo di scarica, lo stato di carica (SoC) può essere determinato misurando la densità dell’elettrolita.
Processo di Ricarica nelle Batterie al Piombo-Acido
Durante la carica, i processi avvengono in direzione opposta, in modo che il solfato di piombo formatosi durante la scarica venga ossidato a piombo e ridotto a biossido di piombo, rispettivamente. Se il solfato di piombo viene completamente consumato e il processo di carica non viene interrotto, inizia l’elettrolisi dell’elettrolita. La sovraccarica con alte tensioni di carica genera gas ossigeno e idrogeno per elettrolisi dell’acqua, che bolle fuori e viene perso. Le batterie sigillate hanno catalizzatori (Pd, Pt) sopra lo sfiato dove il gas ossidrogeno può ricombinarsi in acqua. La tensione della cella risultante può essere determinata dalla serie galvanica. La tensione totale della reazione redox è quindi: E0 = 1.68V – (-0.36V) = 2.04V.
Conclusioni e Sicurezza nell’Uso delle Batterie al Piombo-Acido
In conclusione, le batterie al piombo-acido sono un componente essenziale in molte applicazioni grazie alla loro affidabilità e costo relativamente basso. Tuttavia, è fondamentale gestire queste batterie con cura, mantenendole in posizioni verticali e in ambienti ben ventilati per evitare il rischio associato alla dispersione di gas idrogeno. Inoltre, durante la manutenzione o la sostituzione delle batterie, è importante seguire le linee guida di sicurezza per evitare incidenti legati all’elettrolita corrosivo o ai gas potenzialmente esplosivi.