Batteria al Nichel-Cadmio: Funzionamento e Caratteristiche
Introduzione
La batteria al nichel-cadmio (Ni-Cd), una tipologia di batteria secondaria, utilizza idrossido di nichel Ni(O)(OH) come catodo e cadmio metallico come anodo. Il suo acronimo, Ni-Cd, deriva dai simboli chimici del nichel (Ni) e del cadmio (Cd). Questa batteria si distingue per la bassa impedenza interna, che le conferisce elevate capacità di potenza, ma una capacità di immagazzinamento energetico inferiore rispetto ad altri sistemi di batterie. Nota per la sua lunga durata e la capacità di ricarica rapida, la Ni-Cd può però soffrire di depressione di tensione o effetto memoria, che riduce la tensione massima di carica e di conseguenza la capacità energetica se scaricata superficialmente con continuità.
Impieghi e Limitazioni
Nonostante la sua efficienza, il principale svantaggio della batteria Ni-Cd è il contenuto di cadmio, un metallo estremamente tossico. Ciò rende la Ni-Cd meno adatta come sistema di batteria moderno. Oggi, le applicazioni delle batterie al nichel-cadmio si trovano in dispositivi portatili di piccole dimensioni come attrezzi elettrici, giocattoli, illuminazione di emergenza, strumentazione medica o prodotti industriali portatili. Il loro costo è conveniente per applicazioni a bassa potenza, ma da tre a quattro volte più elevato rispetto alle batterie al piombo-acido per la stessa capacità.
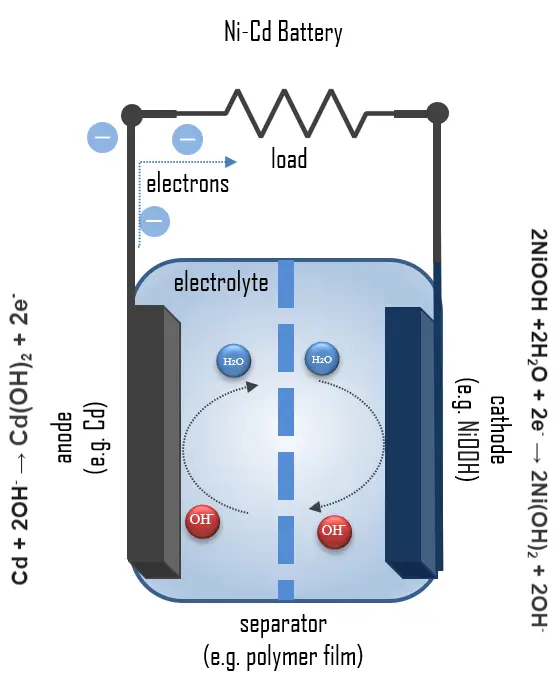
Chimica della Batteria al Nichel-Cadmio
Una cella Ni-Cd completamente carica contiene:
- Catodo: una piastra positiva di idrossido di nichel(III)
- Anodo: una piastra negativa di cadmio
- Separatore
- Elettrolita: un elettrolita alcalino (idrossido di potassio, KOH)
Le batterie Ni-Cd sono generalmente dotate di un involucro metallico con una piastra di sigillatura e una valvola di sicurezza auto-sigillante. Le piastre positive e negative, isolate tra loro dal separatore, sono arrotolate a spirale all’interno dell’involucro. Questo design, noto come “a rotolo di gelatina”, consente alla cella Ni-Cd di fornire una corrente massima molto più elevata rispetto a una cella alcalina di dimensioni equivalenti.
Reazioni Chimiche e Ciclo di Carica/Scarica
Nello stato scarico, l’elettrodo positivo è composto da idrossido di nichel, modificato per soddisfare i requisiti della batteria, e grafite come mezzo conduttivo. Il nichel oscilla tra due stati di ossidazione durante la carica e la scarica;
alla carica, l’idrossido di nichel si trasforma in nichel ossiidrossido (NiOOH) secondo la reazione:
2Ni(OH)2 + 2OH- → 2NiOOH + 2H2O + 2e-
Durante la scarica, le reazioni all’elettrodo di ossido di nichel sono:
2NiOOH + 2H2O + 2e- → 2Ni(OH)2 + 2OH-
L’elettrodo negativo consiste in idrossido di cadmio, Cd(OH)2, che si riduce a cadmio metallico durante la carica. La reazione si inverte durante il processo di scarica, modificando lo stato di ossidazione del cadmio da 0 a 2+, rilasciando due elettroni per ogni atomo di cadmio che partecipa alla reazione. Ecco la reazione per l’anodo durante la carica:
Cd(OH)2 + 2e- → Cd + 2OH-
Le reazioni chimiche all’elettrodo di cadmio durante la scarica sono:
Cd + 2OH- → Cd(OH)2 + 2e-
La reazione complessiva durante la scarica è:
2NiOOH + Cd + 2H2O → 2Ni(OH)2 + Cd(OH)2
Considerazioni Ambientali e di Sicurezza
Il cadmio è un metallo piuttosto pericoloso, pertanto esistono una serie di normative e linee guida su come gestirlo, imposte sia dai governi di tutto il mondo che dall’Unione Europea. L’elettrolita funge da portatore di carica ionica nelle batterie e, per le batterie Ni-Cd, consiste principalmente in idrossido di potassio concentrato (KOH), ma può anche includere aggiunte di idrossido di sodio (NaOH) e idrossido di litio (LiOH).
Conclusioni
Le batterie al nichel-cadmio, nonostante le loro prestazioni elevate in termini di potenza e durata, sono limitate dall’impatto ambientale negativo dovuto al contenuto di cadmio. La loro applicazione rimane quindi confinata a specifici settori in cui le loro caratteristiche uniche sono particolarmente vantaggiose.